
下列合成有机高分子化合物的反应中,属于加聚反应的是( )


A.①② B.③④
C.①③ D.②④
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是 (写序号),得电子能力最强的原子是 (用元素符号表示);
(2)元素④的离子结构示意图为 ;
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):
(4)写出④和⑨形成的化合物的电子式:
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.具有较高能量的分子是活化分子
B.活化分子间的碰撞一定是有效碰撞
C.反应的活化能大小不会影响化学反应速率
D.不同化学反应需要的活化能有可能差别很大
查看答案和解析>>
科目:高中化学 来源: 题型:
酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到乙酸和另一种化学式为C6H14O的物质。对于此过程,以下分析中不正确的是( )
A.C6H14O分子含有羟基
B.C6H14O可与金属钠发生反应
C.实验小组分离出的酯可表示为CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量分解
查看答案和解析>>
科目:高中化学 来源: 题型:
某未知溶液中已检验出含大量的Fe2+、SO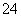 ,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH
,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH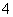 、② SiO
、② SiO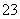 、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
A.①③⑤ B.②⑤⑥
C.①②⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
图187为离子交换膜法电解饱和食盐水的原理示意图,阴极由碳钢网制成,阳极由金属钛网做成(离子交换膜有只允许阳离子通过的阳离子交换膜与只允许阴离子通过的阴离子交换膜)。

图187
(1)若目标产品是从D处引出电解槽中的,则m电极应与电源的________极相连,n电极上的电极反应方程式为________________________________________________________;
精制食盐水应该从________口进入电解池中,从C处出来的液体成 分主要是______________。
分主要是______________。
(2) 当有10 mol某种离子透过L时,理论上电路中通过的电子为________NA;图中的交换膜L属于________(填“阳”或“阴”)离子交换膜,如果取消该交换膜,则溶液中 可能发生的副反应的化学方程式为_______________________________________________________。
可能发生的副反应的化学方程式为_______________________________________________________。
(3)为增大右侧电极区的导电能力,从B处引入的物质不是水而是某种物质的稀溶液,该物质可能是________。
a.NaCl b.NaOH c.Na2CO3 d.KOH
(4)受问题(2)中副反应的启示,人们开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图188),在制备消毒液时,b电极上的电极反应式为________________________________________________________________________。
假设食盐最终全部转化为NaClO,写出电解总反应方程式:________________________________________________________________________
________________________________________________________________________。
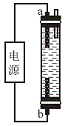
图188
查看答案和解析>>
科目:高中化学 来源: 题型:
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4 溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。

(2)滴定达到终点的标志是 。
(3)产品中FeSO4.7H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com