
【题目】用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A. c(OH-)/ c(NH3·H2O) B. c(NH![]() )/ c(OH-)
)/ c(OH-)
C. c(NH3·H2O)/ c(NH![]() ) D. c(OH-)
) D. c(OH-)
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:图1表示的是六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
回答下列问题:
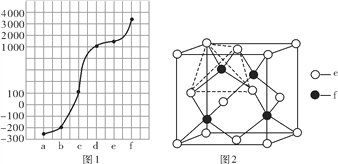
(1)a、b、f三种元素的电负性从小到大的顺序为________(用元素符号表示)。
(2)元素b的单质的一个分子中含有________个σ键和_________个π键。
(3)元素c的单质的晶体堆积方式类型是_______________________;若c单质分别与氟气和氯气形成化合物甲和乙,则甲的晶格能________乙的晶格能(填“>”“<”或“=”)。
(4)元素d的基态原子的价电子排布式为__________________。
(5)元素e和f可形成化合物丙(丙的晶胞结构如图2所示),则丙的化学式为_________;丙的晶体类型为_______________,在丙中,每个e原子周围最近的e原子数目为_____,若晶胞的边长为a pm,则丙的密度为____________g·cm-3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
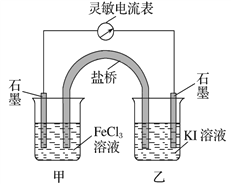
A. 反应时,电子从乙中石墨电极沿导线流向甲中石墨电极
B. 反应时,甲中石墨电极发生还原反应
C. 电流表读数为零时,反应达到化学平衡状态
D. 电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A. Al3+、Na+、HCO3-、[Al(OH)4]-
B. Ca2+、HCO3-、Cl-、K+
C. Fe3+、H+、SO42-、S2-
D. Fe2+、NO3-、Na+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氢氧化钠溶液、铁屑、稀硫酸等试剂制备氢氧化亚铁沉淀,其装置如图所示。
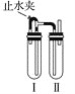
(1)在试管Ⅰ里加入的试剂是____________________。
(2)在试管Ⅱ里加入的试剂是____________________。
(3)为了制得白色氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________________________________。
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值.下列说法错误的是
A. 8.4g NaHCO3固体中含有的离子总数为0.3NA
B. 标准状况下,13.8gNO2与水充分反应转移的电子数目为0.2NA
C. 1L 1molL﹣1的NaClO溶液中ClO-的数目小于NA
D. 常温常压下,23g Na与O2充分反应,生成Na2O和Na2O2混合物时,转移电子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2常用于军事上生产绿色信号弹、曳光弹等。某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等,该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),部分工艺流程如下:
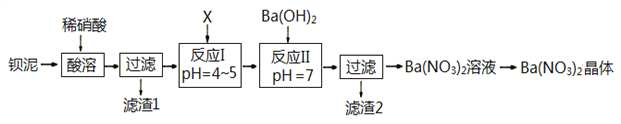
已知:pH=3.2时,可使Fe3+沉淀完全;
请回答下列问题:
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌、过滤、洗涤。试用离子方程式说明提纯原理:______________________________。
(2)酸溶时,Ba(FeO2)2与HNO3反应的化学方程式为_______________________________。
(3)该厂结合本厂实际,化合物X最好选用_________
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)滤渣1和滤渣2洗涤产生的废液不能直接排入环境,原因是_______________________。
(5)①反应I需调节溶液pH值范围在4~5,目的是________________________________。
②验证该步骤中沉淀已完全的实验操作是_____________________________________。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为_____________。(提示:M(Ba(NO3)2)= 261 g/mol,M(BaSO4)= 233 g/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com