
| A. | 在标准状况下,11.2LCI2含有的分子数为NA | |
| B. | 32gO2中所含有的氧原子数为NA | |
| C. | 2.4g镁变成镁离子,转移的电子数为0.2NA | |
| D. | 1L0.3mol/LK2SO4溶液中含有的K+数为0.3NA |
分析 A.依据N=$\frac{V}{22.4}$×NA计算;
B.质量转化为物质的量结合1个氧气分子含有2个氧原子解答;
C.镁为2价金属,2.4g镁的物质的量为0.1mol,0.1mol镁完全反应失去0.2mol电子;
D.根据n=cV计算硫酸钾的物质的量,每摩尔硫酸钾含有2mol钾离子,再根据N=nNA计算离子的数目.
解答 解:A.在标准状况下,11.2LCI2含有的分子数=$\frac{V}{22.4}$×NA=$\frac{11.2L}{22.4L/mol}$×NA=0.5NA,故A错误;
B.32gO2中所含有的氧原子数=$\frac{32g}{32g/mol}$×2×NA=2NA,故B错误;
C.镁为2价金属,2.4g镁的物质的量为0.1mol,0.1mol镁完全反应失去0.2mol电子,转移的电子数为0.2NA,故C正确;
D.1L溶液中含有K+离子数为1L×0.3mol/L×2×NA=0.6NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照不能够发生取代反应 | ||
| C. | 是石油分馏的一种产品 | D. | 比丁烷更易液化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
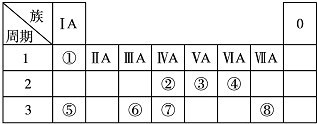
 ,
,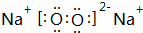 .若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
.若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
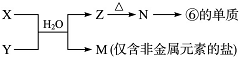
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
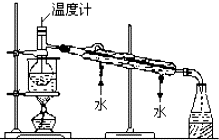 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
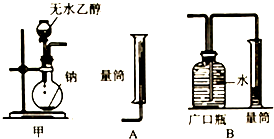
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
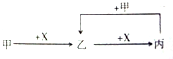
| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为CO2,X为NaOH溶液 | D. | 甲为HCl,X为Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 属于芳香烃 | B. | 分子中苯环上的一氯代物有3种 | ||
| C. | 不能与金属钠发生反应 | D. | 不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )
,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )| A. | 是芳香族化合物 | |
| B. | 能发生加成、取代、氧化反应 | |
| C. | 每个分子中有9个σ键 | |
| D. | 分子极性键又含有非极性键中既含有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com