
【题目】已知A、B为常见的非金属单质且常温下均为气体,甲、乙为金属单质,乙在I的浓溶液中发生钝化,C为极易溶于水的气体而且水溶液呈碱性,而H为一种强碱,各物质间的转化关系如下图(部分生成物末给出,且未注明反应条件):

(1)已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每反应消耗3mol G,转移电子的物质的量为___________mol。
(2)实验室制取C物质的化学方程式为:__________________。
(3)已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:_______。
【答案】2 2NH4Cl+2Ca(OH)2![]() CaCl2+2NH3↑+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
CaCl2+2NH3↑+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
A,B为常见的非金属单质而且常温下均为气体,二者反应生成的C为极易溶于水的气体而且水溶液呈碱性,则C为NH3,氨气催化氧化生成NO和水,D能与氧气反应,说明D是NO,G是二氧化氮,溶于水生成硝酸和NO,则I是硝酸。甲、乙为金属单质,乙在I的浓溶液中发生钝化,甲能与水反应,则甲是钠,生成的H是氢氧化钠,所以乙是Al,与氢氧化钠溶液反应生成偏铝酸钠和氢气,则J是偏铝酸钠,A是氢气,所以B是氮气,据此解答。
根据以上分析可知A为H2,B为N2,C为NH3,D是NO,E是H2O,G是NO2,H是NaOH,I是HNO3,J是NaAlO2。则
(1)反应④为3NO2+H2O=2HNO3+NO,反应中NO2既是氧化剂又是还原剂,物质的量之比为1:2,起氧化剂作用的NO2反应中N元素的化合价由+4降低为+2,则3mol NO2反应转移电子为1mol×(4-2)=2mol;
(2)实验室制备氨气的化学反应方程式为2NH4Cl+2Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)反应⑥为Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。


科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是

A. 图中,AB段的反应为Fe+2Fe3+===3Fe2+,溶液中溶质最终为硫酸亚铁
B. 原溶液中硫酸浓度为2.5 mol·L-1
C. 原混合溶液中硝酸根离子的物质的量为0.2 mol
D. 图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A. 溶液中Ca2+数目增多 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反应中,每生成3molH2时放出30.8kJ的热量。恒温恒容密闭体系内进行上述反应, 下列有关表达正确的是
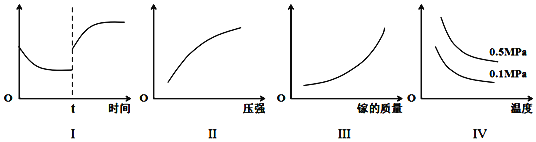
A. I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B. II图像中纵坐标可以为镓的转化率
C. III图像中纵坐标可以为化学反应速率
D. IV图像中纵坐标可以为体系内混合气体平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,B常温下为无色液体,Fe遇浓的G溶液钝化。

(1)写出下列各物质的化学式:
B:____________;F:____________;G:___________。
(2)写出下列变化的反应方程式:
A→D:________________________________________;
G→E:________________________________________。
(3)实验室里,常用加热_____________________的混合物的方法制取气体C,常采用____________法来收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是
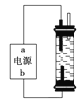
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com