
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
分析 A.NaAlO2水溶液中,水和偏铝酸钠都含有氧原子;
B.氧气分子中含有16个电子,8g氧气的物质的量为0.25mol,含有4mol电子;
C.溶液体积不知不能计算微粒数;
D.氮气和一氧化碳的摩尔质量都是28g/mol,且都是双原子分子.
解答 解:A.NaAlO2水溶液中,水和偏铝酸钠都含有氧原子,所以1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数无法计算,故A错误;
B.8g氧气的物质的量为:$\frac{8g}{32g/mol}$=0.25mol,0.25mol氧气中含有电子的物质的量为:16×0.25mol=4mol,含有4NA个电子,故B正确;
C.溶液体积不知,无法计算溶液中氢氧化钠的物质的量,故C错误;
D.14g氮气和CO的混合气体的物质的量为:$\frac{14g}{28g/mol}$=0.5mol,含有原子的物质的量为1mol,含有的原子数目为NA,故D正确;
故选BD.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,C为易错点,注意明确题中缺少溶液体积,试题培养了学生灵活应用基础知识的能力.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向次氯酸钙溶液中通入过量CO2:2ClO-+Ca2++H2O+CO2═2HClO+CaCO3↓ | |
| C. | 向含0.015 molNaOH的溶液中通入0.64 g SO2:3OH-+2SO2═SO32-+HSO3-+H2O | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Rr2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.
(1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
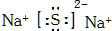 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
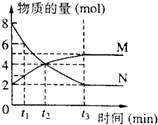
| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1醋酸钠溶液中含有Na+和CH3COO-的总数为0.2NA | |
| B. | 常温下,将0.1 mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA | |
| C. | 2 g NO2和44 g N2O4的混合气体中所含原子的总数为3NA | |
| D. | 0.1 mol甘油醛中含有双键的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com