
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)根据离子反应的实质进行书写;
(3)氧化剂:得到电子,化合价降低,被还原;化合价升高的产物为氧化产物.
解答 解:①铝为金属单质,既不是电解质也不是非电解质;
②蔗糖在熔融状态和水溶液中都不能导电,是非电解质;
③CO2自身不能电离,是非电解质;
④H2SO4在水溶液中能够导电,是电解质;
⑤Ba(OH)2在水溶液中能够导电,是电解质;
⑥HCl在水溶液中能够导电,是电解质;
故属于非电解质的是①②,
故答案为:①②;
(2)离子反应H++OH-=H2O代表强酸和强碱反应生成可溶性的盐和水的反应,如Ba(OH)2+2HCl═BaCl2+2H2O等,
故答案为:Ba(OH)2+2HCl═BaCl2+2H2O;
(3)2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,
KMnO4中锰的化合价由+7价降低为+2价,化合价降低,故KMnO4为氧化剂;
生成物Cl2中氯的化合价升高,故Cl2为氧化产物,
故答案为:KMnO4 Cl2.
点评 本题考查电解质与非电解质的判断、胶体的性质、离子方程式的书写、氧化剂的判断等,题目难度中等,注意掌握离子方程式的书写原则,明确电解质与非电解质的概念及区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液反应:Cl2+2I-═I2+2Cl- | |
| D. | 碳酸钙与足量盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉、生石灰均可作食品抗氧化剂 | |
| B. | 明矾、氯化铁均可作净水剂 | |
| C. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| D. | 碘酒、双氧水均可用于伤口消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视液面 | B. | 未洗涤烧杯和玻璃棒 | ||
| C. | 容量瓶未干燥 | D. | 转移溶液前溶液未冷却至室温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
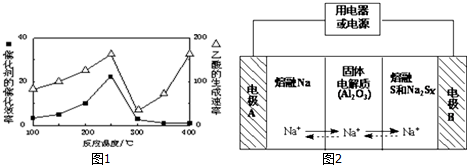
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol H2O2分子中的非极性共价键数为NA | |
| B. | 1L 0.lmol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钢铁发生析氢腐蚀时,0.56gFe反应转移电子数为0.03NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A.任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B.常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C.常温常压下,22.4LH2O中含有的氢原子数为2NA
D.标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com