
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
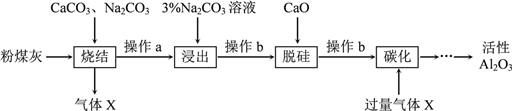
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式_________________________。
(2)操作a为冷却、研磨,其中研磨的目的是________________________。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为_______________。
(4)操作b的名称是_________,所用的玻璃仪器有___________、__________和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为________________。
(6)上述过程中循环使用的物质是_______________。
【答案】(1)Al2O3+Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(2)提高烧结产物浸出率;
(3)FeO2-+2H2O=Fe(OH)3↓+OH-;
(4)过滤;漏斗、玻璃棒;
(5)Al(OH)3;(6)碳酸钙和二氧化碳。
【解析】试题分析:粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等,当加CaCO3、Na2CO3进行烧结,发生Al2O3+Na2CO3![]() 2NaAlO2+CO2↑、Na2CO3+SiO2
2NaAlO2+CO2↑、Na2CO3+SiO2![]() Na2SiO3+CO2↑、2CaCO3+SiO2
Na2SiO3+CO2↑、2CaCO3+SiO2![]() Ca2SiO4+2CO2↑、Fe2O3+Na2CO3
Ca2SiO4+2CO2↑、Fe2O3+Na2CO3![]() 2NaFeO2+CO2↑、C+O2
2NaFeO2+CO2↑、C+O2![]() CO2,所以气体X为CO2,操作a为冷却、研磨,加入碳酸钠溶液浸出,AlO2-+2H2OAl(OH)3+OH-,碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,操作b过滤出Fe(OH)3、Ca2SiO4,加入氧化钙脱硅,氧化钙和水反应生成氢氧化钙,氢氧化钙和硅酸根离子反应生成硅酸钙沉淀,操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,过滤出沉淀氢氧化铝,加热氢氧化铝生成氧化铝和水,电解氧化铝得到铝和氧气。
CO2,所以气体X为CO2,操作a为冷却、研磨,加入碳酸钠溶液浸出,AlO2-+2H2OAl(OH)3+OH-,碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,操作b过滤出Fe(OH)3、Ca2SiO4,加入氧化钙脱硅,氧化钙和水反应生成氢氧化钙,氢氧化钙和硅酸根离子反应生成硅酸钙沉淀,操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,过滤出沉淀氢氧化铝,加热氢氧化铝生成氧化铝和水,电解氧化铝得到铝和氧气。
(1)“烧结“过程中氧化铝和碳酸钠反应:Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,故答案为:Al2O3+Na2CO3
2NaAlO2+CO2↑,故答案为:Al2O3+Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(2)“烧结”过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等,操作a的下一步为浸出,操作a为冷却、研磨,所以研磨的目的是提高烧结产物浸出率,故答案为:提高烧结产物浸出率;
(3)碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,故答案为:FeO2-+2H2O=Fe(OH)3↓+OH-;
(4)浸出液经过两次操作b分离沉淀,所以b为过滤,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯;所以还需用的玻璃仪器有漏斗、玻璃棒,故答案为:过滤;漏斗、玻璃棒;
(5)操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,所以“碳化”时生成沉淀氢氧化铝,故答案为:Al(OH)3;
(6)根据流程图,上述过程中循环使用的物质有碳酸钙和二氧化碳,故答案为:碳酸钙和二氧化碳。


科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能最的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能最和反应物具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法,不正确的是( )
A. 光导纤维的主要成分是二氧化硅
B. 二氧化硅是硅酸的酸酐,但不可以用它和水直接反应来制取硅酸
C. 硅的化学性质不活泼,但在常温下也可和某些物质反应
D. 盛放硅酸钠溶液的试剂瓶不能用玻璃塞的主要原因是硅酸钠溶液水解呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. SO3与SO2 B. BF3与NH3 C. BeCl2与SCl2 D. H2O与SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
①质子数为53中子数为78的碘原子:13153I
②乙烯的结构简式CH2CH2
③硫离子结构示意图: ![]()
④过氧化氢的电子式:![]()
⑤CO2的比例模型: ![]()
⑥乙醇的结构式:CH3CH2OH
⑦丙烷分子的球棍模型: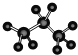
⑧T原子可以表示为31H
A.①③⑤⑥⑦⑧ B.①②③④⑦ C.①⑦⑧ D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
①萃取 ②蒸馏 ③干馏 ④电解
(1)从海水中得到的无水MgCl2中提取金属镁 ;
(2)从海水中提取淡水 ;
(3)把煤转化为焦炉气、煤焦油和焦炭等 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据下面流程,回答以下问题:
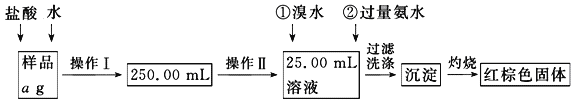
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有___________、___________(填仪器名称),操作Ⅱ必须用到的仪器是___________(填编号)。
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式_________________,加入氨水要过量的原因是________________。
(3)检验沉淀是否已经洗涤干净的操作是____________________。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是_________ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_________________________。(写出一种原因即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com