
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图。下列有关说法正确的是( )
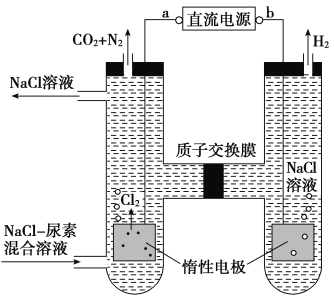
A.a为电源的负极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.阳极室中发生的电极反应为2H++2e-=H2↑
D.若两极共收集到气体13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
【答案】D
【解析】选D。由图可知,右室电解产物为H2,发生还原反应,故b为电源的负极,A错误;阴极反应为6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为6Cl--6e-=3Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应可以看出阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B、C错误;标准状况下,13.44 L气体的物质的量为![]() =0.6 mol,由两极反应可知n(N2)=n(CO2)=0.6 mol×
=0.6 mol,由两极反应可知n(N2)=n(CO2)=0.6 mol×![]() =0.12 mol,生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,则m[CO(NH2)2]=0.12 mol×60 g·mol-1=7.2 g,故D正确。
=0.12 mol,生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,则m[CO(NH2)2]=0.12 mol×60 g·mol-1=7.2 g,故D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A. Na+、Ba2+、Cl-、SO42-
B. Ca2+、HCO3-、C1-、K+
C. MnO4-、K+、I-、H+
D. H+、Cl-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的离子,能在溶液中大量共存的是
A. K+、H+、SO42-、OH- B. Na+、 Ca2+、 CO32-、NO3-
C. Na+、H+、Cl-、CO32- D. Na+、 Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是

A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
(1)下列微粒可以大量共存的是________(填字母)。
a.CO![]() 、HSO
、HSO![]() b.HCO
b.HCO![]() 、HSO
、HSO![]()
c.SO![]() 、HCO
、HCO![]() d.H2SO3、HCO
d.H2SO3、HCO![]()
(2)已知NaHSO3溶液显酸性,解释原因:_____________________________;
NaHSO3的稀溶液中各离子浓度从大到小的排列顺序是_____________________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
Ⅱ.Na2S2O5(焦亚硫酸钠)是常见的食品抗氧化剂之一。
(5)将0.5 mol Na2S2O5溶于水配成1 L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化情况如图所示。写出Na2S2O5溶于水的化学方程式:____________________________;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是________________________。pH=3时,溶液中主要含硫粒子浓度的大小关系为________。
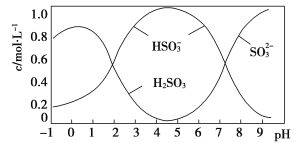
(6)已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO3)=5.0×10-7。将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO![]() 沉淀完全[c(SO
沉淀完全[c(SO![]() )≤1.0×10-5mol·L-1],此时溶液中c(SO
)≤1.0×10-5mol·L-1],此时溶液中c(SO![]() )≤________mol·L-1。
)≤________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在隔绝空气的装置中,将0.2mol铁和铝的混合物溶于400ml c(H+)为2mol/L稀硫酸中,然后滴加1mol/L的NaOH溶液,请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积的变化如图所示。
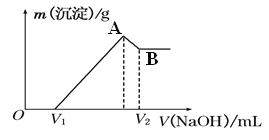
A点时溶液中的溶质有 ;此时溶液刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= 。当V1=300ml时,金属粉末中n(Fe)= mol,V2= ml.
(2)写出AB段有关的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A.在常温常压下,11.2 LN2含有的分子数为0.5 NA
B.71gCl2所含原子数为NA
C.在常温常压下,1molNe含有的原子数为NA
D.在同温、同压下,相同体积的任何气体单质所含的原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3 , 下列说法中正确的是( )
A.氧元素的质量比为1:1
B.分子数之比为1:1
C.原子总数之比为1:1
D.质量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com