
【题目】如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A. AB. BC. CD. D
【答案】C
【解析】
电流计指针偏转,说明该装置构成原电池,M棒变粗,N棒变细,则N为易失电子的活泼金属作负极,不活泼金属M作正极,电解质溶液中阳离子为不活泼金属阳离子。
A项、装置中M电极锌比铜活泼作原电池负极,M极变细,铜作原电池正极,正极上氢离子得电子生成氢气,故A不成立;
B项、装置中N电极铁比铜活泼作原电池负极,铜作原电池正极,正极上氢离子得电子生成氢气,M极不会变粗,故B不成立;
C项、装置中N电极锌比银活泼作原电池负极,N极变细,银作原电池正极,正极上银离子得电子生成银,M极变粗,故C成立;
D项、装置中M电极锌比铁活泼作原电池负极,M极变细,铁作原电池正极,正极上三价铁离子得电子生成亚铁离子,故D不成立。
故选C。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】在20 ℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室。左室充入氮气,右室充入氢气与氧气的混合气体,活塞恰好停留在离左端的1/4处(如下图左所示),然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间(如下图右所示),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是( )
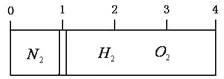

A. 3∶4 B. 4∶5 C. 6:2 D. 7∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 碘水中通入适量的SO2:I2+SO2+2H2O===2I-+SO42-+4H+
B. NH4HCO3溶液与足量NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO32-
D. 向Ca(ClO) 2溶液中通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的离子结构示意图为_______________,E元素在周期表的位置是_____________________。
(2)用电子式表示C的氧化物的形成过程____________________________
(3)比较B、D、E的氢化物的沸点由高至低:_____________________________。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:________________。 。
(5)化学家鲍林在研究含氧酸的强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱 酸 | 中 强 | 强 | 很 强 |
实 例 | HClO | H3PO4 | HNO3 | HClO4 |
①规则判断H2CrO4、HMnO4酸性由强到弱的顺序为_________________。
②As为第ⅤA元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3的分子结构式为________,H3PO3为的结构式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上,铝常用于冶炼难熔金属,这一用途主要是由于铝( )
A.具有强还原性,反应中放出大量的热
B.高温时在空气中能燃烧
C.具有良好导热性
D.反应后生成熔点更高的氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的性质或用途说法正确的是
A. 铝的表面易形成致密氧化物薄膜,故铝制器皿耐腐蚀
B. 聚氯乙烯塑料可做食品包装袋等薄膜制品
C. SiO2常用作半导体材料
D. 明矾常用于水的净化和消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氯碱工业的产品处理含SC/的烟气的流程如下图所示。下列说法错误的是

A. 向NaHSO3溶液中加入少量I2,C(H2SO3)/C(HSO3-)将减小
B. 氯碱工业的产品可以用于生产漂白粉
C. 回收装置中发生的离子反应为HSO3-+H+=SO2↑+H2O
D. 上述流程中可循环利用的物质是NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:
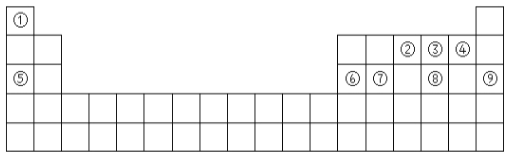
(1)表中能形成两性氢氧化物的元素是(填元素符号)______,最不活泼的元素的原子结构示意图为________。
(2)③号元素和⑧号元素的气态氢化物中,热稳定性较强的是(填化学式)________
(3)④号元素和⑥号元素的离子半径较大的是(填离子符号)_______
(4)上述元素中,金属性最强的元素与非金属最强的元素形成化合物的化学式______
(5)②的氢化物发生催化氧化的化学方程式为___________。
(6)写出⑤号元素的最高价氧化物对应的水化物和⑧号元素的最高价氧化物对应的水化物发生反应的离子方程式_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com