
用惰性电极进行下列电解,有关说法正确的是( )
①电解稀硫酸 ②电解CuSO4溶液 ③电解KOH溶液 ④电解NaCl溶液
A.电解进行一段时间后四份溶液的pH均增大
B.②中电解一段时间后,向溶液中加入适量的CuO固体可使溶液恢复电解前的情况
C.③中阳极消耗OH-,故溶液浓度变小
D.④中阴、阳两极上产物的物质的量之比为2∶1
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
水是生命之源,下列关于水的表达正确的是( )
A.H2O分子的比例模型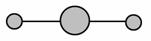
B.H2O和D2O互为同分异构体
C.H2O分子和H2O2分子都含有极性共价键和非极性共价键
D.H2O沸点高于H2S,是因为H2O分子间存在氢键作用,而H2S分子间不存在氢键作用
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为直流电源电解稀Na2SO 4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是 ( )
4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是 ( )
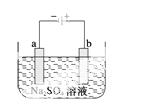
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl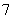 和AlCl
和AlCl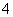 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前的浓度的是( )
A.AgNO3 B.Na2SO4
C.CuCl2 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应A(s)+2B(g)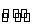 C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如下图所示。下列说法正确的是( )
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如下图所示。下列说法正确的是( )
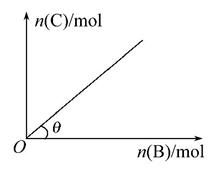
A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通入B,则反应混合物的温度升高
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)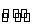 B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如下图所示。回答下列问题:
B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如下图所示。回答下列问题:
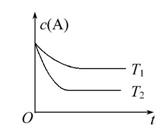
(1)上述反应的温度T1________T2,平衡常数K(T1)________K(T2)。(填“大于”“小于”或“等于”)
(2)若温度T2时,5 min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________。
②反应的平衡常数K=________。
③反应在0~5 min区间的平均反应速率v(A)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三种元素的基态原子的电子排布式如下:① [Ne]3s23p4;② 1s22s22p63s23p3;③1s22s22p5。则上述三种原子的第一电离能大小关系正确的是
A.②>①>③ B.③>①>②
C.③>②>① D.①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com