
| A. | 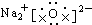 | B. | 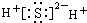 | ||
| C. | 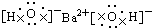 | D. |  |
分析 A、氧化钠为离子化合物,由钠离子与氧离子构成,电子式中相同的原子后离子不能合并.
B、硫化氢为共价化合物,不存在离子键.以共价键形成的物质,必须正确地表示出共用电子对数,并满足每个原子的稳定结构,共价化合物电子式的书写,一般为正价者在前.对于不同价态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边.
C、氢氧化钡为离子化合物,由钡离子与氢氧根离子构成.简单阳离子的电子式为其离子符号,无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.
D、Cl最外层满足8个电子的稳定结构.
解答 解:A、氧化钠为离子化合物,由钠离子与氧离子构成,钠离子不能合并,电子式为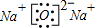 ,故A错误;
,故A错误;
B、硫化氢为共价化合物,不存在离子键,硫原子与氢原子之间形成1对共用电子对,电子式为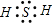 ,故B错误;
,故B错误;
C、氢氧化钡为离子化合物,由钡离子与氢氧根离子构成,电子式为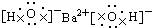 ,故C正确;
,故C正确;
D、CCl4为共价化合物,各原子满足8电子稳定结构,电子式为
点评 本题考查电子式的书写,难度不大,注意未成键的孤对电子对容易忽略,另外分清是离子化合物还是共价化合物是关键.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸根离子的结构式: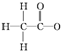 | |
| B. | CO2分子的球棍模型: | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 醛基的电子式为 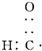 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 继续加入反应物A 2mol,反应速率一定加快 | |
| B. | 温度升高,反应速率一定加快 | |
| C. | 用反应物B表示该反应的反应速率为1.8 mol•L-1•min-1 | |
| D. | 用反应物C表示该反应的反应速率为3.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入溶有足量氨气的BaCl2溶液中,无白色沉淀生成 | |
| B. | 将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 | |
| C. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| D. | 浓硫酸有氧化性,稀硫酸没有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2的质量为32g/mol | |
| B. | 1mol物质的质量等于该物质的相对分子质量 | |
| C. | SO42-的摩尔质量为96g/mol | |
| D. | 1mol CO2的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
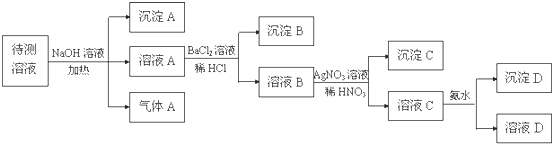
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
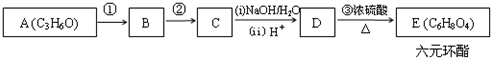
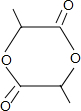 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠投入CuSO4溶液中:2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ | |
| B. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
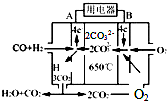 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com