
����Ŀ�����������ƣ�Na2S2O5����һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5 �� ʵ�鲽�����£�
����Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
��.��̼���Ʒ�ĩ����pHΪ7��8��
��.��ͨSO2��pHΪ4.1��
��.�ӹ�������Һ������Na2S2O5���壮
��1���Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
��2��Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� �� ������вⶨ��Һ��pH�ķ�������pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
��3�����õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ����ĥ��������ƿ���У� �� �ظ����ϲ���2�Σ���¼���ݣ���ʵ���б���ʹ�õ��Լ��У�c1molL��1�ı�����Һ��c2molL��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI��
��4��������ˮ�г��������۸�[Cr������]������Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ��������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr��OH��3]=6.4��10��31 �� lg2��0.3��c��Cr3+����1.0��10��5 molL��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr��OH��3����ȥ���������Һ��pH��ΧΪ ��
���𰸡�
��1��Na2CO3+2SO2�TNa2S2O5+CO2
��2��Na2S2O5��ˮ��Ӧ����NaHSO3 �� NaHSO3��ˮ�е���ʹ��Һ�����ԣ���pH�ƣ�����ȼƣ���pH���������ⶨ��Na2SO3
��3������һ������Ĺ�����c1mol?L��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2mol?L��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ������
��4��Na2S2O5��FeSO4?7H2O��Cr2O72����Ӧʱ������H+ �� ʹ��Һ��pH���pH��5.6
���������⣺��1��Na2CO3��SO2��Ӧ����Na2S2O5��CO2 �� ����Ԫ���غ��֪��ѧ����ʽΪNa2CO3+2SO2�TNa2S2O5+CO2 �� ���Դ��ǣ�Na2CO3+2SO2�TNa2S2O5+CO2����2��Na2S2O5��ˮ��Ӧ����NaHSO3 �� NaHSO3��ˮ�е���̶ȴ���ˮ��̶ȣ����Ի�ʹ��Һ�����ԣ��ⶨ��ҺpHֵ��ȷ��Ϊ0.1������pH�ƣ�����ȼƣ���pH���������ȣ���Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ����pH��4.1ʱ������Һ�л�����������ƣ�����Ʒ�л��и�����Na2SO3 ��
���Դ��ǣ�Na2S2O5��ˮ��Ӧ����NaHSO3 �� NaHSO3��ˮ�е���ʹ��Һ�����ԣ���pH�ƣ�����ȼƣ���pH���������ⶨ��Na2SO3����3������������ԭ�ζ���ԭ������Na2S2O5��Һ�м�������ı�����Һ��ʹNa2S2O5�����������ʣ��ı�����Һ���ñ�Na2S2O3��Һ�ζ������ݼ���ĵ����������Na2S2O3��Һ��Ӧ�ĵ�������������Na2S2O5��Ӧ�ĵ����������ȷ��Na2S2O5������������һԭ����֪ʵ���������Ϊ������һ������Ĺ�����c1 molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2 molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��������
���Դ��ǣ�����һ������Ĺ�����c1 molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2 molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ����������4����Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮʱ�������������ӣ�������Һ��pHֵ���������Դ��ǣ�Na2S2O5��FeSO47H2O��Cr2O72����Ӧʱ������H+ �� ʹ��Һ��pH���c��Cr3+����1.0��10��5 molL��1ʱ������Ksp[Cr��OH��3]�������Һ��c��OH����= ![]() =
= ![]() ��10��9 molL��1 �� ����c��H+��=
��10��9 molL��1 �� ����c��H+��= ![]() ��������Һ��PH=��lgc��H+����5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr��OH��3����ȥ���������Һ��pH��5.6�����Դ��ǣ�pH��5.6��
��������Һ��PH=��lgc��H+����5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr��OH��3����ȥ���������Һ��pH��5.6�����Դ��ǣ�pH��5.6��


 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������������Ķ�����Ԫ��a��b��c��d��e�У�a������������Ϊ���������Ķ�����b��d��A2B���⻯���ΪV�η��ӣ�c��+1�����ӱ�e�ĩ�1��������8�����ӣ� �ش��������⣺
��1��Ԫ��cΪ��dΪ
��2������ЩԪ���γɵ�˫ԭ�ӷ���Ϊ ��
��3����ЩԪ�صĵ��ʻ��������γɵ�AB�ͻ������У��侧����������ԭ�Ӿ������ �� ���Ӿ������ �� ����������� �� ���Ӿ����������ÿ����һ�֣�
��4��Ԫ��a��b�γɵ�һ�ֻ�������c��b�γɵ�һ�ֻ�������ķ�Ӧ�����ڷ�������У����ֻ�����ĵ���ʽ�ֱ�Ϊ���� �� �÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƾ�ȼ�յĹ����У�������������ת���������ж�����ȷ����
A.��ѧ�ܲ���ת��Ϊ����B.���ܲ���ת��Ϊ��ѧ��
C.���ܲ���ת��Ϊ��ѧ��D.���ܲ���ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����д��ʵ�����Ʊ�Fe��OH��3��������ӷ���ʽ_______________��
��д��Cl2ͨ�뵽����ʯ��ˮ�е����ӷ���ʽ_______________��
��2����Ba��OH��2��Һ��ͨ������������̼����д��������Ӧ�����ӷ���ʽ_______________��
��3��д��NH4HSO4 ��ˮ��Һ�еĵ��뷽��ʽ_______________��������NH4HCO3 ����Һ�з�Ӧ�����ӷ���ʽ_____________________��
��4��д������������ˮ��Ӧ�����ӷ���ʽ��___________________________________��
��5����֪θ�����Ҫ�ɷ������ᣬ��д����С�մ�Ƭ����θ���������ӷ���ʽ______________��
�������ͬʱ����θ����ʱ��÷���θ��ƽ����Ҫ�ɷ�ΪAl��OH��3������д����Ӧ�ĵ����ӷ���ʽ
_____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء����������������
A. �ɵ�ع���ʱ����ѧ��ת��Ϊ����B. ҽ�þƾ��Ǵ��ƾ�
C. ʳ���ܽ���ˮʱ�ƻ��˻�ѧ��D. �˹��̵��ǵ���ѭ����һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ѧ��ģ���������еķ�Ӧԭ�������������볱ʪ������̼�ķ�Ӧ����
����ͼ��ʾ��������ȡ���������������������

��ͼ�е�����װ��E���ɼס���������������ɣ���������Ƥ����ͨ����װ������ˮ�����п̶���0~ 50mL���������������ҹܿ������ƶ����Ե���Һ��ߵ͡�
ʵ���ҿɹ�ѡ�õ�ҩƷ������ϡ���ᡢϡ���ᡢ�������ơ�̼���ơ�����ʯ��ˮ��
��1������װ�õ�����˳����������ӿڵľ��ţ��������ӽ��ܼ��г�װ�þ�ʡ����____________��
��2��C װ���з���ķ�Ӧ����_________________________��
��3��װ��A��������__________��װ��B��������___________��
��4��Ϊ�˽�ȷ�ز�����������������˱���������װ�õ�������֮�⣬�ڶ�ȡ��Ӧǰ�����Һ��Ķ����������ֵ�Ĺ����У���Ҫע��___________��
A.�����밼Һ����ʹ�ƽ�С�
B.����ϵ�ָ��������ٶ�����
C.�����ƶ��ҹܣ�ʹ�ס���������Һ���ƽʱ�ٶ�����
D.��Ӧֹͣ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ĺϳ�·��������Ϣ��գ� 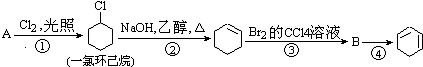
��1��A�Ľṹ��ʽ�� �� ������
��2���ٵķ�Ӧ���������۵ķ�Ӧ������
��3����Ӧ�ܵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���̼��������д�����ǣ�������
A. ̼�����������ﶼ��������������Һ��Ӧ
B. ����̼���ڼ���ʱ������������Ӧ
C. ̼��������ﶼ������ˮ������Ӧ����
D. ̼������Ԫ�ض���ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T��ʱ����ag NH3��ȫ����ˮ���õ�VmL��Һ���������Һ���ܶ�Ϊ��g��cm��3�����ʵ���������Ϊw�����к�NH4+�����ʵ���Ϊbmol��������������ȷ����( )
A. ���ʵ���������Ϊw��![]() ��100%
��100%
B. ���ʵ����ʵ���Ũ��c��![]() mol��L��1
mol��L��1
C. ��Һ��c(OH��)��![]() mol��L��1
mol��L��1
D. ������Һ���ټ���VmLˮ��������Һ���ʵ�������������0.5w
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com