
【题目】磷酸氯喹(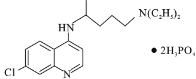 )是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹(
)是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹(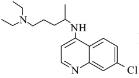 )和磷酸在一定条件下制得。氯喹的合成路线如下:
)和磷酸在一定条件下制得。氯喹的合成路线如下:
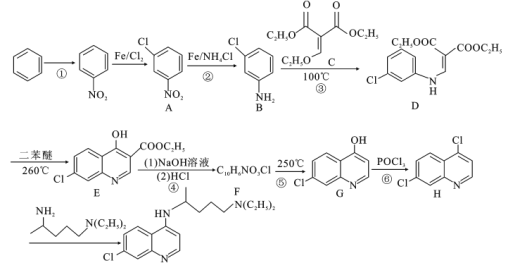
(1)有机物A的名称是___________,E中含氧官能团的名称是___________。
(2)反应①、②的反应类型分别是___________、___________。
(3)写出 的方程式_______________。
的方程式_______________。
(4)F的结构简式是___________。
(5)反应③的另一种产物为___________。
(6)M是H的一种同分异构体,写出满足下列条件的M的结构简式(不考虑立体异构,只需写出2种)____________________。
①分子结构中含有苯环(无其他环),且苯环上有三个取代基;
②能使溴水褪色;
③核磁共振氢谱有4组峰,峰面积之比为2:1:1:1。
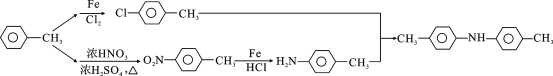
(7)设计由甲苯为起始原料制备 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
【答案】间氯硝基苯或3-氯硝基苯或间硝基氯苯 羟基、酯基 取代反应 还原反应 Cl2+![]()
![]()
![]() +HCl
+HCl  CH3CH2OH
CH3CH2OH 
【解析】
![]() 在浓硫酸催化下,和浓硝酸发生取代反应,生成
在浓硫酸催化下,和浓硝酸发生取代反应,生成![]() ,
,![]() 在铁催化下,和氯气发生取代反应,生成
在铁催化下,和氯气发生取代反应,生成 ,
, 和铁粉、氯化铵发生还原反应,生成
和铁粉、氯化铵发生还原反应,生成 ,
, 与C发生取代反应,生成
与C发生取代反应,生成 和小分子的乙醇,
和小分子的乙醇, 在260℃发生成环,生成E,E在氢氧化钠作用下,酯基发生水解,酸化后生成F(
在260℃发生成环,生成E,E在氢氧化钠作用下,酯基发生水解,酸化后生成F( ),
), 加热脱去羧基,得到
加热脱去羧基,得到 ,
, 和POCl3反应生成
和POCl3反应生成 ,
, 和
和![]() 生成
生成 ,据此解答。
,据此解答。
(1)由合成路线图可知,A为 ,名称为间氯硝基苯或3-氯硝基苯或间硝基氯苯,E的结构为
,名称为间氯硝基苯或3-氯硝基苯或间硝基氯苯,E的结构为 ,含氧官能团的名称是羟基、酯基,故本题答案为:间氯硝基苯或3-氯硝基苯或间硝基氯苯;羟基、酯基;
,含氧官能团的名称是羟基、酯基,故本题答案为:间氯硝基苯或3-氯硝基苯或间硝基氯苯;羟基、酯基;
(2) 反应①发生的是苯环和硝酸发生取代反应,反应②是硝基被还原为氨基,反应类型是还原反应,故本题答案为:取代反应;还原反应;
(3) 是硝基苯和氯气在铁催化下,发生的取代反应,化学方程式为Cl2+
是硝基苯和氯气在铁催化下,发生的取代反应,化学方程式为Cl2+![]()
![]()
![]() +HCl,故本题答案为:Cl2+
+HCl,故本题答案为:Cl2+![]()
![]()
![]() +HCl;
+HCl;
(4)由合成路线图可知,F的结构简式是 ,故本题答案为:
,故本题答案为: ;
;
(5)反应③是 与C发生取代反应,生成
与C发生取代反应,生成 和乙醇,故本题答案为:CH3CH2OH;
和乙醇,故本题答案为:CH3CH2OH;
(6)H的结构式为: ,能使溴水褪色,说明含有碳碳双键或碳碳三键,又含有苯环,且苯环上有三个取代基,无其他环,氢原子个数比为2:1:1:1的结构有
,能使溴水褪色,说明含有碳碳双键或碳碳三键,又含有苯环,且苯环上有三个取代基,无其他环,氢原子个数比为2:1:1:1的结构有

故本题答案为: ;
;
(7)由 先在铁催化下,和氯气发生取代反应,生成
先在铁催化下,和氯气发生取代反应,生成 ,
, 和浓硝酸在浓硫酸的催化下
和浓硝酸在浓硫酸的催化下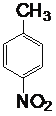 ,
, 和铁粉、盐酸发生还原反应,生成
和铁粉、盐酸发生还原反应,生成 ,
, 和
和 反应生成
反应生成 ,合成路线图为:
,合成路线图为:


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关能量的判断或表示方法正确的是
A.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
B.从C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知相同条件下金刚石比石墨更稳定
C.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,可知:含1 molCH3COOH的稀溶液与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2 H2O(l) △H=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
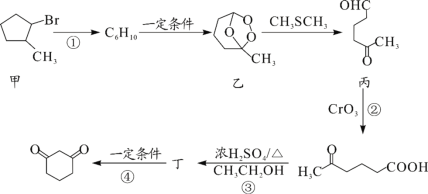
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
A.在35℃,纯水中C(H+)>C(OH-)
B.水的电离度α(25℃)>α(35℃)
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
D.某温度下纯水中C(H+) 为2×10-7mol/L,则此时的C(OH-) 也为2×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________,与CN-互为等电子体的分子是________,离子是________。
(4)Fe、Na、K的晶体结构如图所示。
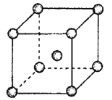
①钠的熔点比钾更高,原因是_____________。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)B、D的元素名称分别为:_____、_____;
(2)E在周期表中的位置为:_____,
(3)C离子的结构示意图为:_____;
(4)B、C、D三种元素的原子半径从大到小的顺序为_____(用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____(用对应的化学式表示)
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:_____;
(7)写出E与水反应的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下列6种物质的序号填空:

(1)属于芳香烃的是__________;
(2)属于卤代烃的是__________;
(3)属于链状饱和烃是__________;
(4)含有碳碳双键的是__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是

A.该电池工作时,CO32-通过隔膜移动到b极
B.若a极消耗1mol碳粉,转移电子数为4NA
C.b极的电极反应式为2CO2+O2-4e-=2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是
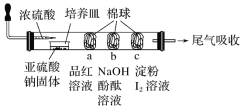
A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com