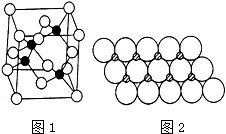
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
(1)下列说法正确的是
(填序号).
A.砷化镓晶胞结构与NaCl相同B.第一电离能As>GaC.电负性As>GaD.原子半径As>Ga
(2)砷化镓可由(CH
3)
3Ga和AsH
3在700℃下反应制得,反应的化学方程式为
.
(3)AsH
3空间形状为
;已知(CH
3)
3Ga为非极性分子,则其中嫁原子的杂化方式为
.
Ⅱ.金属铜的导电性仅次于银,局金属中的第二位,大量用于电气工业.
(4)请解释金属铜能导电的原因
;Cu
2+的核外电子排布式为
.
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH
3)
4]SO
4晶体,晶体中含有的化学键除普通共价键外,还有
和
.
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶胞中距离最近的两个阳离子核间的距离为
cm(用含a的代数式表示).在一定温度下NiO晶体可以自发地分散并形成“单分子层“(如图2),可以认为氧离子做致密单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为
g(氧离子的半径为1.40×10-
10m).

 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:

 名校课堂系列答案
名校课堂系列答案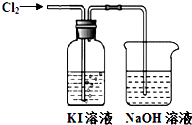 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:



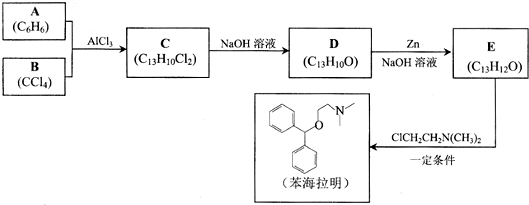
 +CH3Cl
+CH3Cl -CH3+HCl
-CH3+HCl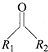
 (1R、R2代表羟基)
(1R、R2代表羟基) 结构;②能与FeCl3溶液发生显色反应,共有
结构;②能与FeCl3溶液发生显色反应,共有