
【题目】某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |

(1)根据上表中的实验数据,可以得到的结论是_______。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是_______。
③若该小组同学提出的假设成立,时间t_______4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______。
【答案】其他条件相同时,增大H2SO4浓度反应速率增大 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) MnSO4 < 试管中取与实验1(或2、3)完全相同的试剂,放在热水中加热后混匀试剂,测褪色所需时间 小于实验1(或2、3)中的褪色时间
【解析】
(1)从表中数据可知改变的条件是H2SO4浓度,当其他条件相同时,增大H2SO4浓度,反应速率增大。
(2)①由图2可知反应开始后速率增大的比较快,说明生成物中的MnSO4或Mn2+为该反应的催化剂。
②与实验1作对比实验,则控制的条件是有无硫酸锰,且其它条件必须相同,所以加入的少量固体为MnSO4。
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min。
(3)为探究温度对化学反应速率的影响,应控制其他条件不变的情况下改变温度来观察实验现象,试管中取与实验1(或2、3)完全相同的试剂,放在热水中加热后混匀试剂,测褪色所需时间小于实验1(或2、3)中的褪色时间。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向 0.1mo1·L-1 的 H2SO4 溶液中滴入 0.1mo1·L-1 过量的 Ba(OH)2 溶液,溶液的导电能力发生变化,其电流强度 (I) 随加入 Ba(OH)2 溶液的体积 (V) 的变化曲线正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
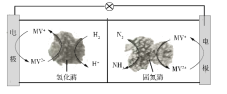
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
(2)在500℃下合成甲醇的反应原理为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
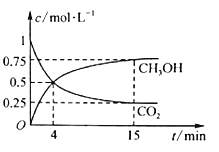
①反应进行到4 min时,v(正)________ (填“>”“<”或“=”)v(逆)。0~4 min,H2的平均反应速率v(H2)= _______。
②下列能说明该反应已达到平衡状态的是_______。
A v正(CH3OH)=3v逆(H2) B CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C 恒温恒压下,气体的体积不再变化 D 恒温恒容下,气体的密度不再变化
③500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
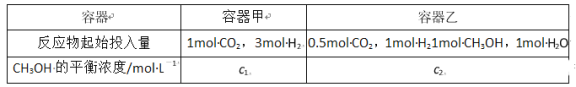
则乙容器中反应起始向_______方向进行;c1_______c2(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
B.V1∶V2=1∶5
C.M点时生成的CO2为0.05 mol
D.e曲线表示的离子方程式为Al(OH)3+3H+===Al3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述不正确的是( )
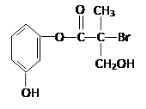
A.该有机物与浓溴水可发生取代反应
B.1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
C.该有机物与浓硫酸混合共热可发生消去反应
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物的结构表示为![]() ,其名称是________________________。
,其名称是________________________。
(2)写出下列反应的化学方程式:
①草酸能使酸性高锰酸钾溶液褪色:____________________________________。
②把浓硝酸、浓硫酸和甲苯混合加热制备TNT:______________________________。
③溴乙烷在一定条件下发生消去反应:__________________________________。
(3)某烃A分子中碳的质量分数为90.57%,在某温度下V L该烃的蒸气质量是相同状况下V L H2质量的53倍,则烃A的分子式为______________;若烃A分子中含有苯环,且苯环上的一氯代物只有一种,则A的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA( )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com