
分析 由电离的HF的物质的量和起始的HF的物质的量来计算电离度;根据电离平衡常数Ka=$\frac{c({F}^{-})•c({H}^{+})}{c(HF)}$计算.
解答 解:HF中氢离子浓度为0.02 mol•L-1,则已经电离的HF的物质的量浓度为0.002 mol•L-1,所以电离度=$\frac{0.002}{0.02}$×100%=10%;
氟化氢溶液,物质的量浓度为0.02 mol•L-1,测得溶液中氢离子浓度为0.002 mol•L-1,则c(F-)=0.002 mol•L-1,
溶液中c(HF)=0.18molmol•L-1,
电离平衡常数Ka=$\frac{c({F}^{-})•c({H}^{+})}{c(HF)}$=$\frac{0.002×0.002}{0.18}$=2.2×10-5;
答:氟化氢的电离度和电离平衡常数分别为:10%和2.2×10-5.
点评 本题考查了弱电解质溶液中的有关算,侧重于考查电离度和电离常数的含义和计算,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③ | C. | ①④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.70g食盐 | |
| B. | 用量筒量取20.00mL未知浓度的盐酸注入锥形瓶 | |
| C. | 用标准NaOH溶液滴定未知浓度的盐酸,用去20.10mL NaOH溶液 | |
| D. | 用广泛pH试纸测某溶液的pH=3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
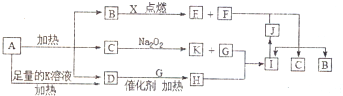
 ,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离度α为10% | B. | α=20% | ||
| C. | pH=1 | D. | c(OH-)=1×10-12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com