
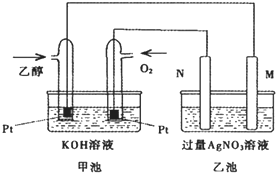
 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
| ||
| ||
| ||
| 4.32g |
| 108g/mol |
| 1 |
| 4 |
| ||
| 46g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、工业上常通过电解熔融的MgO冶炼金属镁 |
| B、将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体 |
| C、牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色 |
| D、溴水不能区别四种有机溶剂:苯、四氯化碳、己烯、无水乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为保护海轮的船壳,常在船壳上镶入锌块 |
| B、纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 |
| C、已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| D、Na2O2与水反应中,氧化剂还原剂都是Na2O2,且1mol Na2O2参加反应有1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2O) |
| c(CO)?c(H2) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |

| P[H2O(g)] |
| P(CO) |
| P[H2O(g)] |
| P(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
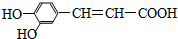 .有关咖啡酸的说法中不正确的是( )
.有关咖啡酸的说法中不正确的是( )| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1 mol咖啡酸可与4 mol H2发生加成反应 |
| D、1 mol咖啡酸最多能消耗3 mol的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、向200mL 2mol/L溴化亚铁溶液中通入11.2L的标况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- |
| C、向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O |
| D、酸性KMnO4溶液吸收SO2:MnO4-+4H++SO2═Mn2++SO42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加人AgN03溶液进行检验 |
| B、为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
| C、通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 |
| D、银氨溶液不能留存,久置后会变成氮化银,容易爆炸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com