
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
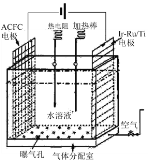
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
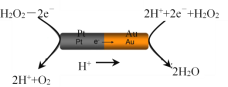
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
【答案】O2+2H2O ![]() 2H2O2 12% 1.0 催化剂对反应速率的影响 正 右
2H2O2 12% 1.0 催化剂对反应速率的影响 正 右
【解析】
(1)利用O2和H2O作原料通过化合制取H2O2,反应条件是电解(通电);
(2)根据单一变量控制法作答;
(3)由图2可知铂(Pt)和金(Au)组成的纳米棒与H2O2溶液形成原电池,H2O2中在铂极失电子发生氧化反应生成氧气和氢离子,结合原电池的工作原理作答。
(1)依据题意可知,利用 O2 和 H2O 作原料通过化合制取 H2O2的总的化学方程式为:O2+2H2O ![]() 2H2O2;
2H2O2;
(2)实验Ⅰ和实验Ⅱ的温度不同,要探究温度对反应速率的影响,其他条件要相同,则Ⅱ中双氧水的质量分数应与Ⅰ相同,为12%;实验Ⅲ没有使用催化剂,Ⅳ使用氯化铁作催化剂,可知这两个实验是探究催化剂对反应速率的影响,要求其他条件相同,控制溶液总体积相同就可使反应物浓度相同,则Ⅲ中应加蒸馏水1.0mL,
故答案为:12%;1.0;催化剂对反应速率的影响;
(3)由图2可知铂(Pt)和金(Au)组成的纳米棒与H2O2溶液形成原电池,H2O2中在铂极失电子发生氧化反应生成氧气和氢离子,氢离子移向正极(Au),氧气形成的气泡推动纳米棒将向右移动,
故答案为:正;右。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是
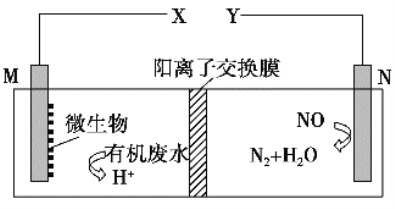
A. 质子透过阳离子交换膜由右向左移动
B. 与X相连接是用电器标有“+”的接线柱
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2)Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为_________、______________、_____________ (各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的两极分别为铅和二氧化铅,电解质溶液为硫酸,工作时的电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列结论正确的是( )
A.铅为正极被氧化
B.溶液的pH不断减小
C.硫酸根离子只向二氧化铅处移动
D.电子由铅极流向二氧化铅极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A.加少量硫酸钠固体
B.改变铝条的表面积
C.升高溶液的温度
D.增大盐酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是( )
A.HCHOB.PH3C.NaHD.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,可逆反应:2NO2(g)![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时生成2nmolNO③用NO2、NO、O2表示的反应速率之比为2∶2∶1④混合气体的颜色不再改变⑤混合气体的密度不再改变⑥混合气体的压强不再改变
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有下列离子Na+ 、Fe3+.、Cl-、Fe2+.、NH4+向其中先加入足量的Na2O2,然后微热并搅拌,再加入足量的稀硫酸原溶液中离子数目基本不变的为( )
A.Na+B.Fe3+C.Cl-D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是

A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com