
| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 常温常压下,30g甲醛所含有的原子数目为4NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
分析 A.甲基所含有的电子数是9;
B.质量转化物物质的量,结合1个甲醛分子含有4个原子解答;
C.戊烷标准状况下不是气体;
D.依据丙烷分子结构计算分析.
解答 解:A.15g甲基的物质的量为$\frac{15g}{15g/mol}$=1mol,故含有的电子数是9×1mol=9mol,即9NA个,故A错误;
B.1个甲醛分子含有4个原子,30g甲醛的物质的量=$\frac{30g}{30g/mol}$=1mol,含有原子数目为4mol,原子数目为4NA,故B正确;
C.戊烷标准状况下不是气体,不能使用气体摩尔体积,故C错误;
D.1mol丙烷(C3H8)所含有的共价键数目为(8+3-1)×NA=10NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积俄体积应用,注意有机物结构及组成,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中c(B-)为1.6×10-3mol/L | |
| B. | 溶液中c(B-)为1.7×10-13mol/L | |
| C. | AB2比AC更难溶解 | |
| D. | 因两者不同类而无法比较其溶解度的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石不是化学变化 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨具有的总能量比1mol金刚石的低 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁能与酸反应,可用于制成红色涂料或颜料 | |
| B. | 烟花的绚丽缤纷是含钾、钠、钙、铜等金属元素的化合物的化学性质的展现 | |
| C. | 医用酒精是用淀粉类植物经糖化再发酵经蒸馏制成,浓度通常是75% | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有抗氧化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
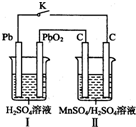 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1mol SO2 | |
| D. | 每生成2mol SO2的同时,消耗2mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com