
| A. | 元素的离子半径A<B<C<E | |
| B. | 工业上利用电解C的氯化物溶液的方法制备单质C | |
| C. | D的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应 | |
| D. | D与C,A与D形成的化合物中化学键类型相同 |
分析 A、B、C、D、E是原子序数依次增大的短周期主族元素.A是电子数等于电子层数的非金属,则A为H元素;B是地壳中含量最多的元素,则B为O元素;C的族序数比A的族序数大1,为第IIA族元素,而且原子序数比O的大,则C为Mg元素;D的次外层电子数等于最内层电子数和最外层电子数之和,则D为S元素,E为Cl,据此结合题目解答.
解答 解:A、B、C、D、E是原子序数依次增大的短周期主族元素.A是电子数等于电子层数的非金属,则A为H元素;B是地壳中含量最多的元素,则B为O元素;C的族序数比A的族序数大1,为第IIA族元素,而且原子序数比O的大,则C为Mg元素;D的次外层电子数等于最内层电子数和最外层电子数之和,则D为S元素,E为Cl;
A.电子层数越多,半径越大,电子排布相同时,原子序数越大离子半径越小,则离子半径:A<C<B<E,故A错误;
B.C为Mg元素,工业上利用电解Mg的氯化物溶液的方法制备单质Mg,故B正确;
C.D为S元素,S的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应,故C正确;
D.S与Mg形成离子键,H与S形成共价键,二者化学键类型不同,故D错误.
故选BC.
点评 本题考查原子结构和元素周期律关系,侧重考查分析、推断能力,明确物质结构、性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的能量变化如图所示: | |
| B. | CO(g)+2H2 (g)═CH3OH(g)△H<-90.5kJ•mol-1 | |
| C. | 2CH4 (g)+3O2 (g)═2CO(g)+4H2O(g)△H<-71.0kJ•mol-1 | |
| D. | 2CH4 (g)+$\frac{1}{2}$O2 (g)═CH3OH( l))△H=-126.0kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液、水 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 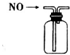 装置可收集NO气体 | |
| B. |  装置可吸收多余氨气且能防止倒吸 | |
| C. |  装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 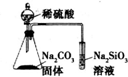 装置可证明非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )| A. | 反应开始时,电子从甲池电极移向乙池电极 | |
| B. | 平衡时电流表指针为零,两池溶液颜色相同 | |
| C. | 平衡时Fe3+氧化性比I2强 | |
| D. | 平衡时向甲池中溶入FeCl2固体后,乙池的石墨电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com