
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(H2A) | c(NaOH) | ||
| ① | X | 0.10 | 9 |
| ② | 0.10 | 0.10 | 5 |
| A. | X<0.1 | |
| B. | HA-的电离程度大于水解程度 | |
| C. | 将实验①所得溶液加水稀释后,$\frac{c({A}^{2-})}{c(H{A}^{-})}$变大 | |
| D. | 实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
分析 A、根据②等浓度的二元弱酸H2A和NaOH溶液等体积混合,得到的是NaHA,溶液显示酸性,所以二元弱酸H2A和NaOH溶液等体积混合,溶液显示碱性,可以是碱剩余,还有可能是生成的正盐水解导致的;
B、根据②等浓度的二元弱酸H2A和NaOH溶液等体积混合,得到的是NaHA,溶液显示酸性,据此回答;
C、实验①所得溶液可以是Na2A,或是Na2A和NaOH的混合物,加水稀释可以促进弱酸阴离子的水解;
D、根据②等浓度的二元弱酸H2A和NaOH溶液等体积混合,得到的是NaHA,溶液显示酸性来判断离子浓度的关系.
解答 解:A、二元弱酸H2A和NaOH溶液等体积混合,溶液显示碱性,可以是碱剩余,还有可能是二者1:2恰好完全反应,生成的正盐水解导致的,所以X<0.1,故A正确;
B、根据②等浓度的二元弱酸H2A和NaOH溶液等体积混合,得到的是NaHA,溶液显示酸性,HA-的电离程度大于水解程度,故B正确;
C、实验①所得溶液可以是Na2A,或是Na2A和NaOH的混合物,加水稀释后,阴离子的水解程度会增大,所以$\frac{c({A}^{2-})}{c(H{A}^{-})}$变小,故C错误;
D、等浓度的二元弱酸H2A和NaOH溶液等体积混合,得到的是NaHA,溶液显示酸性,根据电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),存在物料守恒:(Na+)=c(A2-)+c(HA-)+c(H2A),整理得到:c(Na+)=c(A2-)+c(HA-)+c(H2A),故D正确.
故选C.
点评 本题考查学生酸碱混合后溶液的酸碱性以及溶液中离子浓度之间的关系判断知识,属于综合知识的考查题,难度中等.


科目:高中化学 来源: 题型:选择题
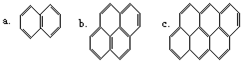 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )| A. | 100% | B. | 56% | C. | 97.3% | D. | 93.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
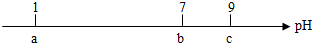
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的质子数相同 | |
| C. | 14C和14N的质量数相同,它们的中子数不等 | |
| D. | 6Li和7Li电子数相同,中子数也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| C. | 煤经过气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5分散在空气中可能形成胶体或浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
数据编号 | NaOH加入的体积/mL | 溶液的PH | ||
| c(HX) | c(HY) | |||
| ① | 0 | 3 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY | |
| B. | 由表中数据可估算出Ka(HY)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(HX)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烯 | D. | 混合气体中一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给容器消毒 | B. | 杀死果实周围的细菌,防止霉变 | ||
| C. | 延长果实或花朵的寿命 | D. | 催熟果实或花朵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
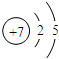 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com