
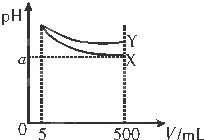
| A. | 稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 | |
| B. | 若X、Y是一元碱,等物质的量浓度的盐酸盐溶液,Y的pH大 | |
| C. | 若X、Y都是一元弱碱,则a的值一定大于9 | |
| D. | 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积:V(X)>V(Y) |
分析 pH=11的X、Y两种碱溶液稀释100倍后,pH都减小,碱性越强的碱,其pH变化越明显,Y减小的程度小于X,则说明X的碱性大于Y,以此解答该题.
解答 解:pH=11的X、Y两种碱溶液稀释100倍后,pH都减小,碱性越强的碱,其pH变化越明显,Y减小的程度小于X,则说明X的碱性大于Y,
A.稀释后X溶液pH小,对水的电离的抑制程度比Y小,则水的电离程度较大,故A错误;
B.Y碱性较弱,如盐酸反应后溶液水解呈酸性,如都为弱碱,则水解程度大于X,Y的pH较小,故B错误;
C.如为强碱,加水稀释100倍,pH为9,若X、Y都是一元弱碱,加水稀释100时,pH大于9,故C正确.
D.Y碱性较弱,等pH时,溶液浓度较大,消耗同浓度稀硫酸的体积较大,故D错误;
故选C.
点评 本题考查了弱碱稀释PH变化曲线,明确弱电解质电离特点是解本题关键,根据pH变化大小确定碱相对强弱,再结合离子水解程度来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 等体积、等浓度的稀溶液Ba(OH)2与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与溴水常温可以反应,而苯与溴水不能反应 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g | B. | 20g | C. | 26g | D. | 28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点对应的溶液中:NH${\;}_{4}^{+}$、Fe3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ | |
| B. | b点对应的溶液中:K+、Na+、NO${\;}_{3}^{-}$、Cl- | |
| C. | c点对应的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、OH- | |
| D. | d点对应的溶液中:Ca2+、NH4+、I-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 澄清石灰水与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com