
| A. | AlCl3和NaOH | B. | NaAl02和H2S04 | C. | Na2C03和HCl | D. | NaHS04和Ba(OH)2 |
分析 A.AlCl3和NaOH反应,当前者滴入后者时,后者开始足量,先无明显现象后有沉淀,当后者滴入前者时,前者开始足量,先沉淀后溶解;
B.NaAlO2和H2SO4反应,当前者滴入后者时,后者开始足量,先有沉淀立即溶解,最终有沉淀,当后者滴入前者时,前者开始足量,先有沉淀后溶解,最终无沉淀;
C.Na2CO3和HCl反应,当前者滴入后者时,后者开始足量,有二氧化碳气体生成,当后者滴入前者时,前者开始足量,先无气体,盐酸过量后有二氧化碳气体生成;
D.NaHSO4和Ba(OH)2反应,无论是前者滴入后者,还是后者滴入前者,现象都是产生白色沉淀.
解答 解:A.AlCl3和NaOH反应,当前者滴入后者时,反应方程式为:开始一段时间Al3++4OH-(过量)=AlO2-+2H2O,当Al3+过量Al3+和AlO2-发生双水解,Al3++3AlO2-+6H2O=4Al(OH)3↓现象是先无明显现象后有沉淀,当后者滴入前者时,前者开始足量,Al3+(过量)+3OH-=Al(OH)3↓,一段时间后OH-过量,Al(OH)3+OH-=AlO2-+2H2O,故A错误;
B.NaAlO2和H2SO4反应,当前者滴入后者时,后者开始足量,先有沉淀立刻溶解,先有沉淀反应方程式为:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓由于H2SO4过量,生成的Al(OH)3立刻被硫酸中和,反应方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,当溶液中铝元素全部变为Al3+时,它与滴入的AlO2-发生双水解反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓现象是最终有沉淀;当后者滴入前者时,前者开始足量,先有沉淀,反应方程式为:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓ 后溶解是由于硫酸过量,反应方程式为:3H2SO4+2Al(OH)3═Al2(SO4)3+6H2O,最终无沉淀,故B错误;
C.Na2CO3和HCl反应,当前者滴入后者时,后者开始足量,有二氧化碳气体生成,反应方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;当后者滴入前者时,前者开始足量,先无气体,反应方程式为:Na2CO3+HCl=NaHCO3+NaCl 盐酸过量后有二氧化碳气体生成,反应方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,故C错误;
D.NaHSO4和Ba(OH)2反应,当前者滴入后者时,后者开始足量,反应方程式为:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,当后者滴入前者时,前者开始足量,反应方程式为:2NaHSO4+Ba(OH)2 =Na2SO4+BaSO4↓+2H2O,无论是前者滴入后者,还是后者滴入前者,现象都是产生白色沉淀,故D正确;
故选D.
点评 本题需掌握氢氧化铝的两性,掌握多元弱酸的盐与酸反应的原理,掌握多元强酸的酸式盐与碱的反应原理,知识储备要求较高.


科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| C. | 工作一段时间后,电解液中的KOH的物质的量不变 | |
| D. | 工作时溶液中K+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
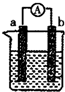 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com