
| A. | 用饱和硫酸铵溶液沉淀蛋白质 | |
| B. | 用生石灰干燥氨气 | |
| C. | 用铝制的容器盛装浓硫酸 | |
| D. | 用饱和碳酸钠溶液收集实验室制取的乙酸乙酯 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断.
A.蛋白质的盐析,属于物理变化;
B.氧化钙与水反应生成氢氧化钙,属于化学变化;
C.浓硫酸使铝发生钝化,在铝的表面形成致密的氧化膜,属于化学变化;
D.碳酸钠和乙酸反应,生成乙酸钠,属于化学变化.
解答 解:A.用饱和硫酸铵溶液沉淀蛋白质:蛋白质的盐析,无新物质生成,属于物理变化,故A正确;
B.用生石灰干燥氨气:氧化钙与水反应,生成氢氧化钙,有新物质生成,属于化学变化,故B错误;
C.用铝制的容器盛装浓硫酸:浓硫酸使铝发生钝化,在铝的表面形成致密的氧化膜,有新物质生成,属于化学变化,故C错误;
D.用饱和碳酸钠溶液收集实验室制取的乙酸乙酯:碳酸钠和乙酸反应,生成乙酸钠,有新物质生成,属于化学变化,故D错误;
故选A.
点评 本题考查物理变化与化学变化的判断,难度不大.要注意化学变化和物理变化的本质区别是否有新物质生成.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
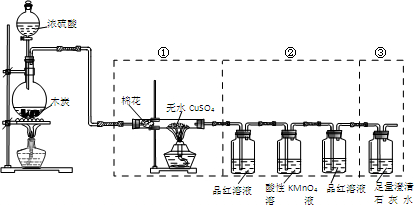
| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
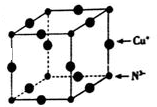 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
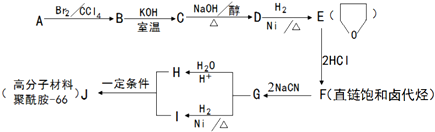
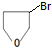 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O.
+NaBr+H2O.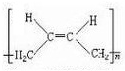 .
.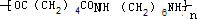 +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
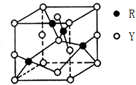 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
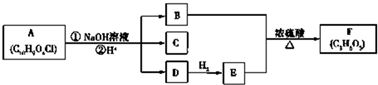
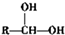 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$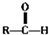 (R为羟基)
(R为羟基) .
. .
.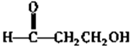 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
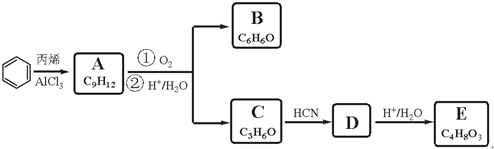
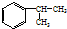 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.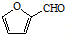 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式 .
. G:
G: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
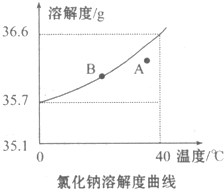 根据氯化钠的溶解度曲线,完成下列问题.
根据氯化钠的溶解度曲线,完成下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com