
��һ�ܱ������г���1 mol H2��1 mol I2��ѹǿΪp��Pa������һ���¶��·�Ӧ��H2��g�� + I2��g��  2HI��g�� ��H��0��ƽ���ı�����,����������ȷ����
2HI��g�� ��H��0��ƽ���ı�����,����������ȷ����
A�����������ݻ����䣬�����м���1 mol N2��N2���μӷ�Ӧ������Ӧ���ʼӿ�
B�������ʼ�ķ�Ӧ�¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ�����ƽ�������ƶ�
C����������������ѹǿ���䣬�����м���1 mol Ne����Ӧ���ʼӿ죬ƽ�������ƶ�
D����������������ѹǿ���䣬�����м���1 mol H2��g����1 mol I2��g������Ӧ���ʼӿ�
 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ����У��һ�����л�ѧ���������棩 ���ͣ������
�����¼������ʣ���ʳ�ξ����ͭ��KNO3��Һ�����ڵ��������آ�Һ̬�Ȼ��������̼�߾ƾ����ش��������⣨����ţ���
�����������ܵ������ �����ڵ���ʵ��� �����ڷǵ���ʵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡޭ���ظ�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ��ƶ���
ij��ɫ����Һ�п��ܴ�������Na+��Mg2+��Ag+��Cu2+��Fe3+�������е�һ�ֻ��֣�����д���пհף�
��1�������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ������ǣ� ��
��2��ȡ����ԭ��Һ�����������ϡ���ᣬ�а�ɫ�������ɣ��ټ��������ϡ���ᣬ��������ʧ��˵��ԭ��Һ��һ�����ڵ������ǣ� ���йص����ӷ���ʽ ��
��3��ȡ��2���е���Һ�����������NaOH���ְ�ɫ������˵��ԭ��Һ�϶��� ���йص����ӷ���ʽ ��
��4��ԭ��Һ�����ܴ������ڵ��������� ��
A��Cl- B��NO3- C��CO32- D��OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡޭ���ظ�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������������ɢϵ�ı�����
A������ķ�ɢ������ֱ����1nm��100nm֮��
B���������Ӵ���ɲ�����һ�����������ȶ�����
C���������Ӳ��ܴ�����Ĥ����ͨ����ֽ��϶
D������ͨ������ʱ�ж����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡޭ���ظ߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��Ҫ����գ�
��1����ϡ������ε��뵽���з�̪��NaOH��Һ�У��ɹ۲쵽��������____________����Ӧ�����ӷ���ʽΪ��_______________
��2����������N2��O2��ȫ��Ӧ��ÿ����23g NO2��Ҫ����16.95kJ���������Ȼ�ѧ����ʽΪ_______________________
��3����֪C��ȼ���Ȧ�H=-393.5kJ/mol����24 g C��O2����ȫȼ������CO2��g���ų�������Ϊ_________kJ��
��4����ҵ�ϳ�����Ȼ����Ϊ�Ʊ�CH3OH��ԭ�ϣ���֪��
��CH4��g��+O2��g��=CO��g��+H2��g��+H2O��g�� ��H=-321.5kJ/mol
��CH4��g��+H2O��g��=CO��g��+3H2��g�� ��H=+250.3kJ/mol
��CO��g��+2H2��g��=CH3OH��g�� ��H=-90.0kJ/mol
CH4��g����O2��g����Ӧ����CH3OH��g�����Ȼ�ѧ����ʽΪ ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡޭ���ظ߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ�ǿ��淴Ӧ2Y2 Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����
Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����
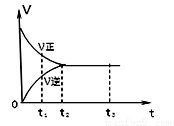
A��t1ʱ��ֻ��������Ӧ
B��t2- t3����Ӧ���ٷ���
C��t2- t3�������ʵ�Ũ�Ⱦ�û�з����仯
D��t2ʱ����Ӧ�����ȣ�����Ӧ���淴Ӧ��������ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
ij��Ԫ��H2A��ˮ�еĵ��뷽��ʽ��H2A=H����HA����HA�� H����A2�����ش��������⣺
H����A2�����ش��������⣺
(1) Na2A��Һ�� (����ԡ��������� �����ԡ�)�������� (�����ӷ���ʽ���Ҫ������˵��)��
�����ԡ�)�������� (�����ӷ���ʽ���Ҫ������˵��)��
(2) �����£���֪0.1 mol��L��1NaHA��ҺpH��2����0.1 mol��L��1H2A��Һ�������ӵ����ʵ���Ũ�ȿ��� 0.11 mol��L��1(����ڡ��������ڡ���С�ڡ�)�� ������ ��
(3) 0.1 mol��L��1NaHA��Һ�и�������Ũ���ɴ�С��˳����
(4) Na2A��Һ�У����б�����ȷ����
A.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
B.c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
C.c(OH-)=c(HA-)+c(H+)+2c(H2A)
D.c(OH-)=c(HA-)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ɳ����ԭ�����͵���( )
A��500�����ұ����¸������ںϳɰ��ķ�Ӧ
B����ѹ�����ںϳɰ��ķ�Ӧ
C��SO2��������SO3�ķ�Ӧ��������Ҫʹ�ô���
D��ʵ���ҳ����ű���ʳ��ˮ�ķ����ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ��������ƽ�ظ߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���дʻ���������ʵ���ɫ������ϵ����
A����ɫ���� B����ɫ���� C���� ɫ��Ⱦ
ɫ��Ⱦ  D����ɫʳƷ
D����ɫʳƷ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com