
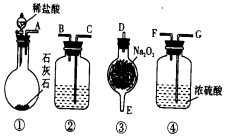
 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.分析 (1)装置②目的是除去反应中过量的CO2;
(2)仪器的连接方法:先制备反应物,然后除杂质,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用CO2和Na2O2反应制O2,据此答题;
(3)装置②作用是除去反应中过量的CO2;除二氧化碳用澄清石灰水,澄清石灰水和二氧化碳反应生成碳酸钙和水.
解答 解:(1)装置②目的是除去反应中过量的CO2,故用碱性物质澄清石灰水,注意选项B,虽然是碱性物质,但是饱和二氧化碳不溶于饱和NaHCO3溶液,
故答案为:C;
(2)仪器的连接方法:先制备反应物,然后除杂质,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用CO2和Na2O2反应制O2,则应先制取CO2,再与Na2O2反应,最后除杂,并收集气体,故仪器连接顺序为①③②④,
故答案为:①;③;②;④;
(3)装置②的作用是除去反应中过量的CO2;除二氧化碳用澄清石灰水,澄清石灰水和二氧化碳反应生成碳酸钙和水,CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:除去反应中过量的CO2;CO2+Ca2++2OH--=CaCO3↓+H2O.
点评 本题难度不大,理解常温下CO2能和Na2O2反应制取O2的实验,明确实验过程中带来的气体杂质有H2O和CO2,选择合适的试剂并将其除去是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 该反应是加成反应 | |
| B. | 若R为CH3时,b中所有原子可能共面 | |
| C. | 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种 | |
| D. | 若R为C4H5O时,lmol b最多可以与6mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com