
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是( )

A.湿润的蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸褪色,证明SO2具有漂白性
C.湿润的淀粉-KI试纸未变蓝,说明SO2的氧化性强于I2
D.蘸有酸性KMnO4溶液的滤纸褪色,证明SO2具有漂白性
科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)物质G的化学式:______。
(2)物质B的电子式:______。
(3)写出A→D的化学方程式:______;G→E的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
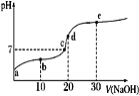
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中加入Y试剂,产生的沉淀示意图与下图所示情形吻合的是(注意线段的斜率)
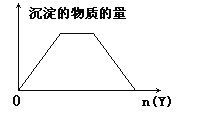
A.向NaOH和Ca(OH)2的混合溶液中通入CO2B.向HCl和AlCl3的混合溶液中滴加NaOH
C.向NH4Al(SO4)2溶液中滴加NaOHD.向NH4Cl和MgCl2的混合溶液中滴加NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了验证臭氧的氧化性强于氧气,进行了下述实验,请参与探究并回答相关问题。
[实验目的]验证臭氧的氧化性强于氧气。
[实验原理]2KI+O3+H2O=2KOH+I2+O2,淀粉溶液遇单质碘变蓝色。
[实验用品]臭氧消毒碗柜、a溶液、碘化钾溶液、滤纸、玻璃片、温度计。
[实验步骤]
①取a溶液与碘化钾溶液混合。
②取两片用滤纸剪成的纸条,在a和碘化钾的混合液中湿润后分别置于两块洁净的玻璃片上。
③将一块玻璃片(Ⅰ)置于臭氧消毒碗柜中并接通电源生成臭氧。将另一块玻璃片(Ⅱ)置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
时间(min) | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
滤纸的颜色变化 | 玻璃片(Ⅰ)上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
请根据上述实验原理、步骤及你所学的知识,回答下列问题:
(1)实验药品中的a溶液是__________溶液。
(2)写出在臭氧消毒柜中产生O3的化学方程式:_____。
(3)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是_________。
(4)从实验数据记录可以得出的结论是____(填序号)。
A. O3的氧化性比O2强
B. 氧气也能氧化碘化钾中的碘离子
C. 空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的
D. O3不仅氧化I-的速率比氧气快,而且有漂白作用
(5)在O3氧化KI的反应中,若有9.6 g O3发生反应,则转移的电子的物质的量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.铁与盐酸反应:2Fe+6H+==2 Fe3++ H2↑
B.在氯化铝溶液中滴加过量的氨水:Al3++4 OH﹣═ AlO![]() +2 H2O
+2 H2O
C.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH﹣═ Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图所示装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。请回答下列问题:
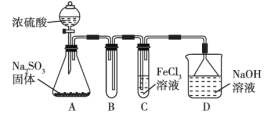
(1)通入足量SO2时C中观察到的现象为______。
(2)根据以上现象,该小组同学认为SO2与FeCl3发生了氧化还原反应。
请设计实验方案检验有Fe2+生成:____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有______(填序号)。
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称保险粉,实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。
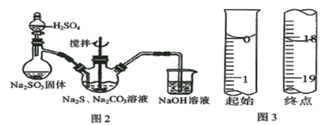
(1)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是____________,三颈烧瓶中发生反应的化学方程式______________。
(2)保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol·L-1碘的标准溶液进行滴定。请回答:
①到达滴定终点的标志_______________。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为____mL,产品的纯度为______________(设Na2S2O3·5H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的纯度的测量结果___________(填“偏高”、“偏低”或“不变”)。
(3)某研究小组以硫代硫酸钠与硫酸反应来探究外界条件对反应速率的影响,设计实验如下:
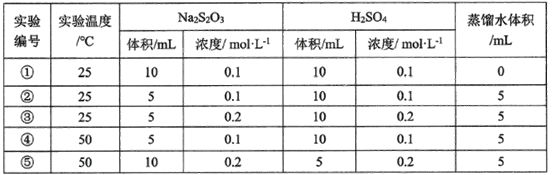
下列有关说法不正确的是__________________
A.该同学在实验中采用的研究方法是实验比较法
B实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
C.实验①和③溶液变浑浊的时间相同
D.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
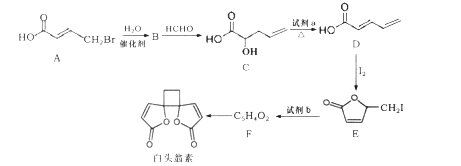
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
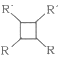
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成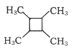 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com