
| A. | 将块状药品研细后再反应 | |
| B. | 食物储存在冰箱里 | |
| C. | 用MnO2作H2O2分解反应的催化剂 | |
| D. | 用30% H2SO4溶液代替5% H2SO4溶液与锌粒反应 |
分析 A.增大反应物接触面积,则增大反应速率;
B.降低温度,减慢反应速率;
C.用MnO2作H2O2分解反应的催化剂能增大反应速率;
D.较浓的稀硫酸能增大反应速率.
解答 解:A.增大反应物接触面积,则增大反应速率,将块状药品研细后再反应能增大反应物接触面积,所以能加快反应速率,故A错误;
B.降低温度,减慢反应速率,温度降低,降低活化分子百分数,所以能减慢反应速率,故B正确;
C.用MnO2作H2O2分解反应的催化剂能降低反应所需活化能,所以增大反应速率,故C错误;
D.较浓的稀硫酸中氢离子浓度增大,增大单位体积内活化分子数,所以能增大反应速率,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,浓度、温度、催化剂、反应物接触面积都能影响反应速率,注意外界条件的适用范围,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
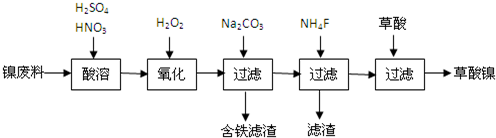

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol | B. | 0.7mol | C. | 0.6mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HF>HCl>HBr>HI | |
| B. | 非金属最高氧化物的水化物酸性:HClO4>H2SO4>H2PO4>H2SiO3 | |
| C. | 金属最高价氧化物的水化物碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 挥发性:HCl>HNO3>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. | 等质量的甲烷、乙烯、乙炔分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 苯酚、水杨酸( )和苯甲酸都是同系物 )和苯甲酸都是同系物 | |
| D. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉在唾液淀粉酶的作用下转变成麦芽糖 | |
| B. | 淀粉中含有葡萄糖 | |
| C. | 淀粉在唾液淀粉酶的作用下转变成葡萄糖 | |
| D. | 淀粉是糖类物质有甜味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com