
| A. | 催化剂是影响化学反应速率的本质因素 | |
| B. | 当反应体系容积不变时,减小反应物的量肯定能降低反应速率 | |
| C. | 可逆反应达到反应限度时,化学反应速率为0 | |
| D. | 化学反应速率可用单位时间内反应物的浓度变化量来表示 |
分析 A、影响化学反应速率的本质因素是物质本身的性质;
B、如果反应物是固体物质,量变但浓度不变;
C、平衡状态是动态平衡;
D、化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示.
解答 解:A、影响化学反应速率的本质因素是物质本身的性质,而催化剂是外界因素,故A错误;
B、如果反应物是固体物质,量变但浓度不变,所以当反应体系容积不变时,减小反应物的量不一定能降低反应速率,故B错误;
C、平衡状态是动态平衡,所以达到反应限度时,化学反应速率不为0,故C错误;
D、化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示,即可用单位时间内反应物的浓度变化量来表示,故D正确;
故选D.
点评 本题考查化学反应速率及其影响因素等有关知识,侧重考查影响因素,明确化学反应速率概念、影响因素等即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 10 | C. | 104 | D. | 10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
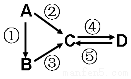 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶物一定是铜 | B. | 不溶物一定是铁 | ||
| C. | 不溶物中一定含铜,但不一定含铁 | D. | 滤液中可能含有CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ql>Q2 | |
| B. | 反应物总能量均高于生成物总能量 | |
| C. | 1molHBr(g)具有的能量大于1molHBr(l)具有的能量 | |
| D. | 反应①生成2 molHCl(l)时放出Q1热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4和 NaCl 的物质的量之比为 1:3 | |
| B. | 溶液中一定有 1molNa2SO4 和 3molNaCl | |
| C. | 所带电荷数 SO42-是 Na+的 $\frac{3}{5}$ 倍 | |
| D. | SO42-与 Cl-的物质的量之和等于 Na+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
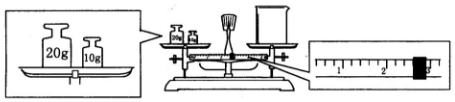
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com