
【题目】铝制品比铁制品在空气中不易被锈蚀,原因是( )
A. 铝的金属性比铁弱B. 铝在空气中易与氧气形成一层致密的氧化膜
C. 铝的密度比铁的密度小D. 铝不能与氧气发生化学反应
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有(填一种);
(2)下列物质不需要经过化学变化就能从海水中获得的物质是 (填序号);
A.液溴
B.食盐
C.氢气
D.淡水
(3)从海水中提取溴和镁的流程如下: 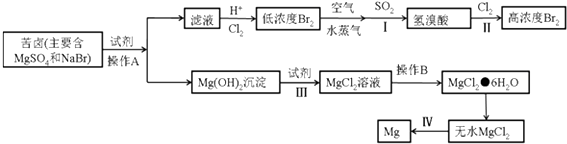
①写出下列步骤的离子方程式或化学方程式,
步骤I的化学方程式: ,
步骤III的离子方程式: ,
步骤IV的化学方程式: .
②操作A是 , 操作B是 , 从步骤II得到的溶液中提取溴还需要进行的操作有:、萃取、蒸馏.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G 为肉桂酸乙酯,是一种天然香料,自然界产量较低,利用A 可合成肉桂酸乙酯,其路线如下: 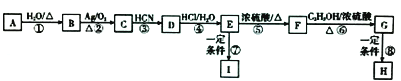
已知:①A 属于单取代芳香烃,其相对分子质量为104.
②  ③肉桂酸乙酯的结构简式为
③肉桂酸乙酯的结构简式为 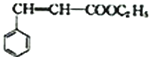
④I、H 均为高分子化合物.
按要求回答下列问题:
(1)A 的结构简式为;C 的化学名称为 .
(2)由C 生成D 的反应类型为;由F 生成G 的化学方程式为 .
(3)反应⑦⑧生成高分子化合物反应原理(填“相同”或“不相同”),若H 的平均相 对分子质量为10630,则其平均聚合度约为(填编号).
a.56 b.58 c.60 d.62
(4)K 的相对分子质量比G 的大2,K 的同分异构中能同时满足下列条件的共有种
(不含立体异构).
①能发生银镜反应; ②加入氯化铁溶液呈紫色; ③苯环上有三个间位的取代基.
其中核磁共振氢谱显示为6 组峰,且峰面积比例为9:1:1:1:1:1 的是
(写结构简式).
(5)根据上述有关信息和合成路线表示方式,写出C2H5OH 的原料合成乳酸 ( ![]() )的路线(其他试剂任选) .
)的路线(其他试剂任选) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化肥的合成、废水的处理等有现实的重要意义.
(1)硝酸铵的生产方法是采用硝酸与氨气化合,工业合成氨是一个放热反应,因此低温有利于提高原料的转化率,但实际生产中却采用400~500℃的高温,其原因是;工业生产中,以氨气为原料合成硝酸,写出工业生产硝酸的最后一步的化学方程式 .
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:![]() 已知:CO+H2O
已知:CO+H2O ![]() CO2+H2
CO2+H2
①甲厂以焦炭和水为原料;
②乙厂以天然气和水为原料;
③丙厂以石脑油(主要成分为C5H12)和水为原料.
按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高.据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高? .
(3)将工厂废气中产生的SO2通过下列流程如图1,可以转化为有应用价值的硫酸钙等.
①写出反应Ⅰ的化学方程式: .
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 .
③检验经过反应Ⅲ得到的氨态氮肥中SO42﹣所用试剂是 . 
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.图2是氯碱工业中电解饱和食盐水的原理示意图.
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 .
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过化学反应一步完成的是( )
A. CO2→H2CO3 B. SiO2→Na2SiO3 C. Na2O2→Na2CO3 D. SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( ) 
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn﹣2e﹣=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸的叙述,错误的是( )
A. 硅酸是一种很弱的酸
B. 硅酸可由二氧化硅与水反应制得
C. 硅酸不稳定,加热脱水会生成二氧化硅
D. 硅酸可以由可溶性硅酸盐与盐酸反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10 mL 0.01 molL﹣1KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com