
| A、①③④ | B、①②③④ |
| C、全部 | D、③④ |


科目:高中化学 来源: 题型:
| A、甲烷的分子式为CH4 |
| B、甲烷气体中含碳元素和氢元素 |
| C、甲烷气体中只含碳元素和氢元素 |
| D、甲烷的化学性质比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的沸点;蒸发水所需热量 |
| B、水的密度;水中通入足量CO2后溶液的pH |
| C、水的体积;水的质量 |
| D、水的物质的量;水的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶于水:CH3COOH=CH3COO-+H+ |
| B、熔融状态下的NaHSO4:NaHSO4=Na++H++SO42- |
| C、碳酸氢钠溶于水:HCO3-+H2O?CO32-+H3O+ |
| D、硫化氢溶于水:H2S?2H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
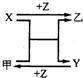 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
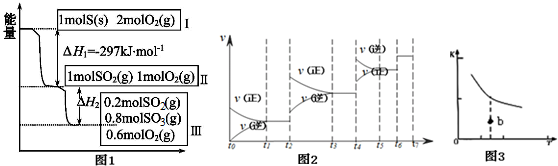
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com