
| A. | 过氧化氢的电子式: | B. | S2-的结构示意图: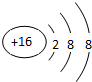 | ||
| C. | 氟化钙的电子式: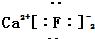 | D. | CO2分子的结构式:O=C=O |
分析 A.双氧水为共价化合物,电子式中不需要标出所带电荷;
B.硫离子最外层电子数是8;
C.氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边;
D.二氧化碳中碳原子与2个氧原子通过共用四对电子形成共价化合物.
解答 解:A.双氧水为共价化合物,电子式中不需要标出所带电荷,此表示方法正确,故A正确;
B.硫元素的原子序数是16,得到2个电子达到8个电子的稳定结构,故B正确;
C.氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边,氟化钙的电子式为: ,故C错误;
,故C错误;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 结构式为O=C=O,故D正确,故选C.
结构式为O=C=O,故D正确,故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、元素符号、离子结构示意图、电子排布式等知识,明确常见化学用语的书写原则为解答结构,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s13p3 | B. | 1s22s22p63s23p63d104s14p1 | ||
| C. | 1s22s22p63s23p63d24s2 | D. | 1s22s22p63s23p63d104s14p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
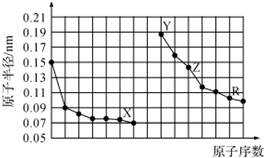
| A. | X、Y分别是O、Na元素 | |
| B. | R的单质与足量X2反应生成RX3 | |
| C. | Z的氧化物熔点很高,是较好的耐火材料 | |
| D. | 电解熔融的Z的氧化物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
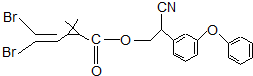 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图.下列对该化合物叙述不正确的是( )| A. | 属于芳香族化合物 | B. | 属于卤代烃 | ||
| C. | 含有官能团酯基 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
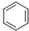 +CH3CH2CH2Cl$\stackrel{催化剂}{→}$
+CH3CH2CH2Cl$\stackrel{催化剂}{→}$ 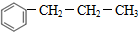 +HCl
+HCl
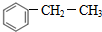 ,F的结构简式为
,F的结构简式为 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| B. | 氯水、氨水、浓硝酸都要存放在棕色瓶里 | |
| C. | 铵态氮肥不能与草木灰混合使用,但可以暴晒在太阳底下 | |
| D. | SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
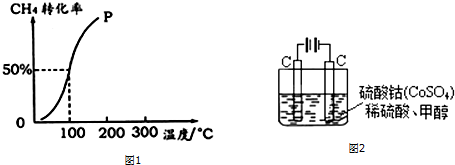
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com