
| A. | ②④⑤①③⑥ | B. | ⑤②④①③⑥ | C. | ④②⑤①③⑥ | D. | ②⑤④③①⑥ |
分析 除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,过滤后在滤液中加入适量盐酸除去过量的强氧化钠和碳酸钠,最后结晶析出纯净的氯化钠.
解答 解:要先用BaCl2溶液除去SO42-,然后再用Na2CO3溶液除去Ca2+,碳酸钠还可以除去过量的钡离子,所以碳酸钠一定加在氯化钡的后面,如果加反了,过量的钡离子就无法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠可加盐酸调节,只要将三种离子除完,过滤除去不溶物,最后加盐酸除去过量的氢氧根离子、碳酸根离子,最好将滤液蒸发结晶得到氯化钠晶体,
所以正确的操作顺序为:⑤②④①③⑥,
故选B.
点评 本题主要考查了盐的性质、除杂的方法和原则,除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
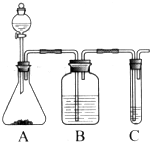 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质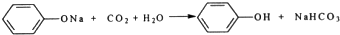 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+)随着温度的升高而降低 | |
| B. | 35℃时纯水中c(H+)═c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | 向水中加入NaHCO3溶液会抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的结构中存在碳碳单键 | |
| B. | 苯在一定条件下能发生取代反应 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯和乙烯都能与溴水发生反应而使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在氢氧化钡溶液中加入过量的小苏打Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 在氢氧化钾的稀溶液中通入过量的二氧化硫气体 SO2+OH-═HSO3- | |
| C. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| D. | 在氢氧化钠溶液中通入过量的H2S H2S+2OH-═S2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
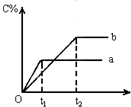 如图为A(气)+B(气)?nC(气)+Q在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图为A(气)+B(气)?nC(气)+Q在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 若其它条件相同,a比b的温度高 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 反应由逆反应开始 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
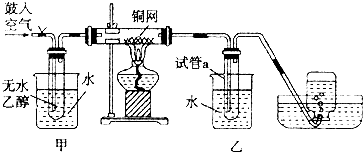
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com