
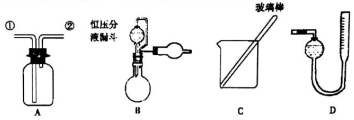
分析 (1)Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,根据反应方程式即可算出Zn的质量分数;
(2)计算生成氢气的物质的量,根据电子守恒计算Zn的质量,进而计算Zn的质量分数;
(3)可以获得Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积可求出Zn的厚度;
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,加入氢氧化钠溶液排出空气体积会计算在生成氢气的体积之内;
(5)锌与氢氧化钠反应溶解,铁与氢氧化钠不反应,所以固体减少的质量为锌的质量,据此解答;
(6)实验中产生氢气的量较少,测量氢气质量带来的误差更大.
解答 解:(1)Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,根据反应方程式即可算出Zn的质量分数,所以需要的装置有测H2的体积的D装置,
故答案为:D;
(2)根据电子转移守恒,可知n(Zn)=n(H2)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,则w (Zn)=$\frac{\frac{V}{22.4}×65}{m{\;}_{1}}$=$\frac{65V}{22.4m{\;}_{1}}$,故答案为:$\frac{65V}{22.4m{\;}_{1}}$;
(3)有可以获得Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积可求出Zn的厚度,
故答案为:金属锌的密度;
(4)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大;
故答案为:偏大;
(5)锌与氢氧化钠反应溶解,铁与氢氧化钠不反应,所以固体减少的质量为锌的质量,则锌的质量分数为:$\frac{m{\;}_{1}-m{\;}_{2}}{m{\;}_{1}}$;
故答案为:$\frac{m{\;}_{1}-m{\;}_{2}}{m{\;}_{1}}$;
(6)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大;
故答案为:劣于.
点评 本题考查物质含量测定,关键是测定原理的理解,侧重考查学生分析问题、设计实验的能力,注意定量实验中尽可能的减少误差.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量为17 g•mol-1 | |
| B. | 所含的分子数目约为9.03×1023 | |
| C. | 在标准状况下体积约为33.6L | |
| D. | 溶于水制成0.5L溶液时物质的量浓度为1.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
现有0.01mol/L的下列溶液:①CH3COOH ②NaHCO3 ③NaHSO4 ④KOH ⑤H2SO4按pH由小到大的顺序排列的是 ( )
A.⑤③①②④ B.③⑤① ②④ C.⑤②③①④ D.④②①③⑤
②④ C.⑤②③①④ D.④②①③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在含有酚酞的0.1 mol / L氨水中加入少量的 NH4Cl晶体,则溶液颜色( )
A.变蓝色 B.变深 C.变浅 D.不变
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结 |
A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
B | 向稀的苯酚水溶液中滴加饱和溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 还原性:Cl- > I- |
D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com