
从海水制备金属镁的流程如图所示:
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl2溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
(1)CaCO3 CaO+CO2↑;CaO+H2O=Ca(OH)2
CaO+CO2↑;CaO+H2O=Ca(OH)2
(2)Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2(2分) (3)熔点低,硬度大
解析试题分析:(1)贝壳的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和CO2,氧化钙溶于水即生成氢氧化钙,有关反应的化学方程式是aCO3 CaO+CO2↑;CaO+H2O=Ca(OH)2。
CaO+CO2↑;CaO+H2O=Ca(OH)2。
(2)氢氧化钙与氯化镁发生复分解反应生成氢氧化镁白色沉淀和氯化钙,反应化学方程式是Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2。
(3)合金与其成分的金属相比,硬度大,熔点低。
考点:本题考查从海水中提取镁的原理、化学方程式和离子方程式的书写。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:单选题
19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了 ( )
| A.大量铝土矿 | B.电解氧化铝制取铝的方法 |
| C.用金属钠还原氧化铝的方法 | D.无水氯化铝与钾制取铝的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式 ;
②写出“联合制碱法”有关反应的化学方程式________________。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同______________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹____(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康
(1)含有较多______________的水称为硬水,硬水加热后产生沉淀的离子方程式为__________________________( 写出生成一种沉淀物的即可) 。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图: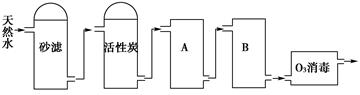
①活性炭的作用是__________________;O3消毒的优点是________________。
②A、B中放置的物质名称分别是:A__________________;B_______________。A、B中放置的物质是否可以互换?请说明原因________________________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某 城 市 用 水 中c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3_)为8.0×10-4mol/L。如用药剂软化该1000L ,应加入Ca(OH) 2 g , Na2CO 3 __________ g 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为 ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为 (用离子符号表示),其中形成的化合物中能发生潮解的是 (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式: 。
②Be(OH)+与强碱溶液反应的离子方程式: 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是 (选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳

 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐

 精盐
精盐

 滤液
滤液
 食盐晶体
食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从海水制备金属镁的流程如图所示:
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl 溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PCl5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是: 、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某复合材料是以人工碳纤维为增强体、金属钛为基体复合而成的。估计这种材料具有的性质或用途是( )。
①耐高温;②不耐热;③导电、导热;④不导电、不导热;⑤可用于飞机机翼;⑥可用于导弹的壳体
| A.①③⑤⑥ | B.②③⑤⑥ |
| C.②③④ | D.③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com