我国是镁资源最为丰富的国家之一.
(1)将1mol镁铝合金(Mg
17Al
12)完全溶解于12L 6mol/L的盐酸中,放出氢气
mol,为使反应后溶液中的Mg
2+、Al
3+完全沉淀,需加入10mol/L的氨水至少
L.
(2)灼烧碱式碳酸镁可得到MgO.取碱式碳酸镁4.66g,灼烧至恒重,得到2g固体和1.76g CO
2,某学生为确定碱式碳酸镁的化学式列了以下联立方程:
24+17x+60y+18z=4.66÷(
)…①
2-x-2y=0…②
(
)×(0.5x+z)×18=4.66-2-1.76…③
(a)①式表达的是求算碱式碳酸镁摩尔质量的关系式,则②式表达的是
;
(b)以上关系式是正确的,据此可求出该碱式碳酸镁的化学式为
.
(3)氧化镁可用于烟气脱硫,反应原理为:
MgO+H
2O→Mg(OH)
2 Mg(OH)
2+SO
2→MgSO
3+H
2O
MgSO
3+H
2O+SO
2→Mg(HSO
3)
2 2MgSO
3+O
2→2MgSO
4某小组模拟脱硫过程如下(实验在25℃进行):将MgO加入水中,不断搅拌,通入SO
2和空气,得到550g滤液和若干克滤渣.取55g滤液依次加入足量的盐酸和BaCl
2溶液,得到0.897g白色沉淀;另取55g滤液加入足量氯水和BaCl
2混合溶液,得到1.992g白色沉淀.分析知滤渣中含MgSO
3 16.82g(其它成分不含硫元素).
(1)该实验过程中吸收的SO
2的物质的量为
mol;消耗氧气的物质的量为
mol.
(2)Mg(HSO
3)
2易溶于水;25℃溶解度,MgSO
4:33.7g/100g水;MgSO
3:0.652g/100g水.试通过计算确定550g滤液中镁盐的成分及物质的量(写出计算过程).



 初中学业考试导与练系列答案
初中学业考试导与练系列答案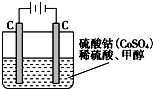
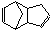 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.