
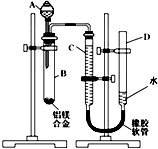
 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.| 33600(a-c) |
| b |
| 33600(a-c) |
| b |
| (a-c) |
| a |


科目:高中化学 来源: 题型:
A、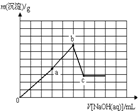 |
B、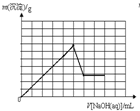 |
C、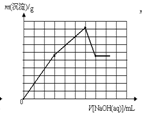 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
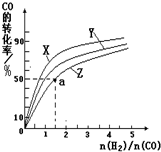 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
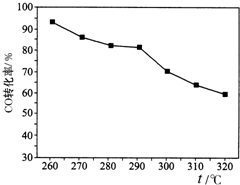 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁、氯化钡、碳酸钠、硫酸 |
| B、盐酸、硝酸铵、氢氧化钠、硝酸钠 |
| C、氢氧化钠、稀硫酸、碳酸钠、硫酸氢钠 |
| D、氯化钡、硫酸钠、氯化钙、硝酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 |
| B、溶于水后加入AgNO3溶液,看是否有白色沉淀生成 |
| C、加入AgNO3溶液,看是否有白色沉淀生成 |
| D、溶于水后先加入Ba(NO3)2溶液,再加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com