
分析 (1)根据离子方程式的书写方法来书写离子方程式,在氧化还原反应中,化合价降低元素所在的反应物是氧化剂,对应产物是还原产物,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物,根据硝酸的作用以及方程式进行计算.
(2)①碳酸氢钙溶液与少量的烧碱溶液反应生成碳酸钙、碳酸氢钠和水;
②石灰水和醋酸反应生成醋酸钙和水;
③向NaHSO4溶液中滴加入NaHCO3溶液,反应生成硫酸钠和水、二氧化碳;
④FeCl3溶液与氨水混合反应生成氢氧化铁沉淀和氯化铵;
⑤足置的CO2通入到氢氧化钙溶液中,反应生成碳酸氢钙;
解答 解:(1)铜和硝酸反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,化合价降低元素的N元素所在的反应物HNO3是氧化剂,对应的产物NO是还原产物,在参加反应的8mool硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,当生成标况下3.36L即0.15molNO时,参加反应的硝酸的物质的量为0.6mol,其中被还原的硝酸的物质的量为0.15ml,此时转移电子的物质的量为0.15×3=0.45moL,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;NO;0.15;0.45;
(2))①碳酸氢钙溶液与少量的烧碱溶液反应生成碳酸钙、碳酸氢钠和水,离子方程式:Ca2++HCO3-+OH-=H2O+CaCO3↓;
故答案为:Ca2++HCO3-+OH-=H2O+CaCO3↓;
②石灰水和醋酸反应生成醋酸钙和水,离子方程式:CH3COOH+OH-=CH3COO-+H2O;
故答案为:CH3COOH+OH-=CH3COO-+H2O;
③向NaHSO4溶液中滴加入NaHCO3溶液,反应生成硫酸钠和水、二氧化碳,离子方程式:H++HCO3-=H2O+CO2↑;
故答案为:H++HCO3-=H2O+CO2↑;
④FeCl3溶液与氨水混合反应生成氢氧化铁沉淀和氯化铵,离子方程式:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
故答案为:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
⑤足置的CO2通入到氢氧化钙溶液中,反应生成碳酸氢钙,离子方程式:CO2+OH-=HCO3-;
故答案为:CO2+OH-=HCO3-.
点评 本题考查了离子方程式的书写,氧化还原反应基本概念及计算,明确反应实质及氧化还原反应规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
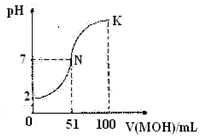
| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
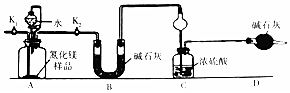
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
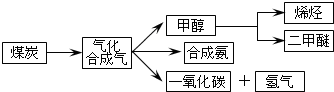
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com