
【题目】A、B、C、D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是
A. 0.1 moL D物质溶于100 mL 2.5 mol·L-1的D溶液中
B. 9.2 g B物质(式量为46)溶于水配成100 mL溶液
C. 1.806×1023个C的分子溶于水配成100 mL溶液
D. 10 mL 5mol·L-1的A溶液加水配制成100 mL溶液
【答案】A
【解析】
A、若体积近似不变,100 mL 2.5 molL-1D溶液中溶质的物质的量n=2.5 molL-1×0.1L=0.25mol,则0.1 moL D物质溶于100 mL 2.5 molL-1D溶液中,溶质的物质的量浓度约为c=0.35mol÷0.1L=3.5 molL-1;
B、9.2 g B物质(式量为46)的物质的量为9.2 g÷46g/mol=0.2mol,溶于水配成100 mL溶液的物质的量浓度c=0.2mol÷0.1L=2molL-1;
C、1.806×1023个C分子的物质的量n=![]() =0.3mol,溶于水配成100 mL溶液的物质的量浓度c=0.3mol÷0.1L=3molL-1;
=0.3mol,溶于水配成100 mL溶液的物质的量浓度c=0.3mol÷0.1L=3molL-1;
D.稀释前后溶质的物质的量不变,则10 mL×5molL-1=100 mL×c,解得c=0.5molL-1;
所以物质的量浓度最大的是A;答案选A.


科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() =2.14),向20 mL 0.01 mol·L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
=2.14),向20 mL 0.01 mol·L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
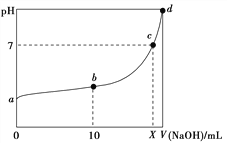
A. HNO2的电离方程式为HNO2===NO![]() +H+
+H+
B. a点H2O电离出的c(H+)=2.14×10-3 mol·L-1
C. b点溶液中离子浓度大小关系为c(NO![]() )>c(Na+)>c(H+)>c(OH-)
)>c(Na+)>c(H+)>c(OH-)
D. X值等于20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | Cu(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
A. 20 mL 3 mol·L-1 B. 20 mL 2 mol·L-1
C. 10 mL 4 mol·L-1 D. 10 mL 2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述可能正确的是
A. 增大了反应的活化能 B. 增大了反应的速率
C. 降低了反应的焓变 D. 增大了反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)加入过量BaCl2目的是__________________________________。
(2)第④步中,相关的化学方程式是_______________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解(______)
B.天平的砝码已锈蚀(______)
C.定容摇匀时,液面下降又加水(______)
D.定容时俯视刻度线(______)
查看答案和解析>>
科目:高中化学 来源: 题型:
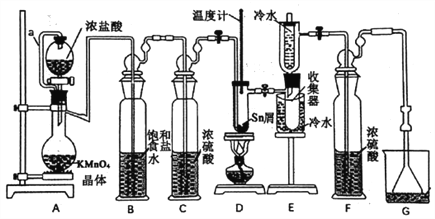
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为___________。
(2)当观察到装置F液面上方出现___________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是___________、___________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为___________ 。
(4)若制得产品中含有少量Cl2,则可采用下列___________(填字母)措施加以除去。
A.加入NaOH萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(5)可用碘量法测定最后产品的纯度,发生如下反应:Sn2++I2=Sn4++2Iˉ。准确称取该样品m g放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol·L-1碘标准溶液滴定至终点,消耗标准液20.00mL,则产品中SnCl2的含量为___________(用含m的代数式表示);即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是___________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶上的有关数据,该浓盐酸中HCl的物质的量浓度为________mol/L。某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸:

(2)该学生需要量取_______mL上述浓盐酸进行配制。
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)_______、_______。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)_____________________;
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1~2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是_____________________
A.摇匀后静置,发现液面低于刻度线,继续加水至与刻度线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com