
| ��Ӧ���� | ��Ӧʱ�� | CO2��mol�� | H2��mol�� | CH3OH��mol�� | H2O��mol�� |
| ���� ���� ��T1�桢 2L�� | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
���� ��1����֪����2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol
��CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+49.0kJ/mol
��˹���ɼ����-�١�$\frac{3}{2}$�õ��״�ȼ������H2O��g�����Ȼ�ѧ����ʽ��
��2�����Է����е��ж������ǡ�H-T��S��0����Ϸ�Ӧ���������ж���Ҫ��������
��ƽ���־�����淴Ӧ������ͬ������ֺ������ֲ��䣬ԭ���DZ����������ѡ�
��3����0��10min���������ʵ����仯6mol-4.5mol=1.5mol������������ʾ�ķ�Ӧ���ʣ�����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�����õ�ˮ��ʾ�ķ�Ӧ���ʣ�
��ͼ���м���20minʱ������̼�������ʵ���1mol��ͬʱ����1mol�״���30min�״����ʵ���Ϊ1mol����20min��Ӧ���ƽ��״̬��������м�����ʽ����ƽ��Ũ�ȣ���������ת���ʺ�ƽ�ⳣ����
����������������������ͼ����ƽ��״̬���������ʵ���Ϊ3mol����30minʱ�ı��¶�ΪT2�棬��ʱH2�����ʵ���Ϊ3.2mol��˵������ƽ��������У��������������������£���30minʱ���������ٳ���1mol CO2��g����1mol H2O��g���������ʱŨ���̺�ƽ�ⳣ���Ƚ��жϷ�Ӧ���з���
��4��������Ϊȼ�ϵ�ص�ԭ�ϣ������ڸ���ʧ���ӷ���������Ӧ�����ݵ缫��д����д���缫��Ӧ��
��� �⣺��1����1����֪����2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol
��CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+49.0kJ/mol
��˹���ɼ����-�١�$\frac{3}{2}$�õ��״�ȼ������H2O��g�����Ȼ�ѧ����ʽ��CH3OH��g��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��g����H=-676.4kJ/mol��
�ʴ�Ϊ��CH3OH��g��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��g����H=-676.4kJ/mol��
��2����2CO��g��+4H2��g��?CH3OCH3��l��+H2O��l����H=+71kJ/mol���ر��S��0����Ӧ�ʱ��H��0����H-T��S��0�����������H-T��S��0����Ӧ�����Է����У�
�ʴ�Ϊ�����ܣ�
����1L�ܱ������м���2mol CO��4mol H2��������Ӧ��2CO��g��+4H2��g��?CH3OCH3��l��+H2O��l����H=+71kJ/mol��
a����������ƽ����Է����������ֲ��䲻��˵�����淴Ӧ������ͬ����a����
b����ʼ���ͱ仯��֮����ͬ��CO��H2��ת����ʼ����ȣ�����˵����Ӧ���ƽ��״̬����b����
c�����������ﶼ��Һ�壬�����������ʼ�ղ��䣬CO��H2������������ֲ��䲻��˵����Ӧ���ƽ��״̬����c����
d����Ӧǰ������������䣬���������仯�������������ܶȱ��ֲ���˵����Ӧ���ƽ��״̬����d��ȷ��
e��1mol CO���ɵ�ͬʱ��1mol O-H�����ѣ�ֻ��˵����Ӧ������У�����˵�����淴Ӧ������ͬ����e����
�ʴ�Ϊ��d��
��3����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H��0��0��10min���������ʵ����仯6mol-4.5mol=1.5mol������������ʾ�ķ�Ӧ����v��H2��=$\frac{\frac{1.5mol}{2L}}{10min}$=0.075mol/��L•min��������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�v��H2O��=$\frac{1}{3}$v��H2��=0.025mol/��L•min����
�ʴ�Ϊ��0.025mol/��L•min����
��ͼ���м���20minʱ������̼�������ʵ���1mol��ͬʱ����1mol�״���30min�״����ʵ���Ϊ1mol����20min��Ӧ���ƽ��״̬��
CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H��0
��ʼ����mol/L�� 1 3 0 0
�仯����mol/L�� 0.5 1.5 0.5 0.5
ƽ������mol/L�� 0.5 1.5 0.5 0.5
ƽ�ⳣ��K=$\frac{0.5��0.5}{0.5��1��{5}^{3}}$=$\frac{4}{27}$��
����ת����=$\frac{1.5mol/L}{3mol/L}$��100%=50%��
�ʴ�Ϊ��$\frac{4}{27}$��50%��
����������������������ͼ����ƽ��״̬���������ʵ���Ϊ3mol����30minʱ�ı��¶�ΪT2�棬��ʱH2�����ʵ���Ϊ3.2mol������ӦΪ���ȷ�Ӧ��˵������ƽ��������У�T1��T2���������������������£���30minʱ���������ٳ���1mol CO2��g����1mol H2O��g����Qc=$\frac{0.5����0.5+0.5��}{��0.5+0.5����1��{5}^{3}}$=$\frac{4}{27}$=K��˵��ƽ�ⲻ����
�ʴ�Ϊ�������÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ƽ�������ƶ�������
��4�����ü�����Ϊȼ�ϵ�ص�ԭ�ϣ������ڸ���ʧ���ӷ�Ӧ������Ӧ���ڼ��Խ����е�ظ����ĵ缫��Ӧʽ��CH3OCH3-12e-+16OH-=2CO32-+11H2O��
�ʴ�Ϊ��CH3OCH3-12e-+16OH-�T2CO32-+11H2O��
���� ���⿼�����Ȼ�ѧ����ʽ��д��ƽ��Ӱ�����ط����жϡ�ƽ�����ķ���Ӧ�á���д��ע��ͼ�����ݵķ����жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ���� | B�� | Ũ���� | C�� | ϡ���� | D�� | ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӽ����ײһ��������ѧ��Ӧ | |
| B�� | ���ȷ�Ӧֻ�м��Ȳ��ܷ��� | |
| C�� | �������仯��һ���ǻ�ѧ��Ӧ | |
| D�� | �л�ѧ�����Ѳ�һ��������ѧ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������������������������ɵ���Ⱦ��Ŀǰ�о�����Ҫ���⣮
��������������������������ɵ���Ⱦ��Ŀǰ�о�����Ҫ���⣮| t/min n��NO��/mol T | 0 | 40 | 80 | 120 | 160 | |
| �� | T�� | 2 | 1.45 | 1 | 1 | 1 |
| �� | 400�� | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
| �� | 400�� | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ������ʾ����Ӧ�������ⵥ�����ɣ�Cu ��������
������ʾ����Ӧ�������ⵥ�����ɣ�Cu �������� ��
�� ��Ϊ��Ҫ�л�ԭ�ϣ���ԭ����ѡ����д���ϳɼ�����ĺϳ���·��
��Ϊ��Ҫ�л�ԭ�ϣ���ԭ����ѡ����д���ϳɼ�����ĺϳ���·�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��CH3CH2��2CHCH3��ϵͳ����Ϊ2-�һ����� | |
| B�� | ���ᣨHCOOH�����Ҷ��ᣨHOOC-COOH����Ϊͬϵ�� | |
| C�� | �л���CH3-CH2-NO2��H2N-CH2-COOH��ͬ���칹�� | |
| D�� | H2��D2��Ϊͬλ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | c��Na+����2c��CO32-�� | B�� | C��Na+��+c��H+���Tc��HCO3-��+c��OH-��+c��CO32-�� | ||
| C�� | C��Na+���T2[c��HCO3-��+c��CO32-��+c��H2CO3��] | D�� | C��OH-���Tc��HCO3-��+c��H+��+c��H2CO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
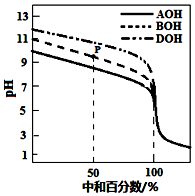 �����£�����ͬ���ʵ���Ũ�ȵ�HCl��Һ���ֱ�ζ����ʵ���Ũ�Ⱦ�Ϊ0.1mol•L-1�����ּAOH��BOH��DOH����Һ���ζ���������ͼ��ʾ�������ж���ȷ���ǣ�������
�����£�����ͬ���ʵ���Ũ�ȵ�HCl��Һ���ֱ�ζ����ʵ���Ũ�Ⱦ�Ϊ0.1mol•L-1�����ּAOH��BOH��DOH����Һ���ζ���������ͼ��ʾ�������ж���ȷ���ǣ�������| A�� | �ζ�ʱ������������Һ�ĵ��룬ˮ�������c��H+��ʼ������ | |
| B�� | �ζ���P��ʱ����Һ�У�c��Cl-����c��B+����c��BOH����c��OH-����c��H+�� | |
| C�� | pH=7ʱ��������Һ��c��Cl-�� ��� | |
| D�� | ���кͰٷ�����100%ʱ����������Һ��Ϻ�c��AOH��+c��BOH��+c��DOH��=c��H+��-c��OH-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com