
分析 只用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别,以此来解答.
解答 解:①将AlCl3溶液滴入NaOH溶液中,先没有明显现象,后生成白色沉淀,将NaOH溶液滴入AlCl3溶液中,先生成白色沉淀,后白色沉淀溶解,二者现象不同,可鉴别,故①正确;
②无论是Ca(HCO3)2溶液滴入NaOH溶液中,还是NaOH溶液滴入Ca(HCO3)2溶液中,都产生白色沉淀,二者现象相同,不能鉴别,故②错误;
③Na2CO3溶液滴入盐酸中,立即产生气体,若将盐酸滴入Na2CO3溶液中,开始没有气体生成,后有气体生成,二者显现不同,可鉴别,故③正确;
④将AgNO3溶液滴入氨水中没有明显现象,将氨水滴入AgNO3溶液中,先生成白色沉淀,后白色沉淀溶解,二者显现不同,可鉴别,故④正确;
故答案为:①③④.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意与量有关的离子反应及络合反应,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 | |
| D. | 中子数为39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
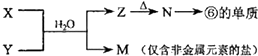 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
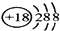
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 剩余固体 | Cu(NO3)2、CuO | Cu2O、CuO | Cu2O、CuO | Cu(NO3)2、Cu2O |
| 剩余气体 | 无气体剩余 | 氧气2.5×10-3mol | NO 2.5×10-3mol | 氧气2.5×10-3mol |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| W | |||||||
| X | Y | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
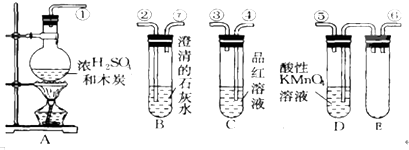
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
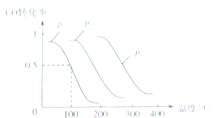 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH>7的溶液中:K+、AlO2-、Cl-、SO42- | |
| B. | 含有0.1mol/L Fe3+的溶液中:K+、Mg2+、I-、SCN-、HCO3- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 在由水电离产生c(H+)=1×10-13mol/L的溶液中:Na+、S2O32-、Fe3+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com