
 Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是| A.溶液中Ca2+数目不变 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
科目:高中化学 来源:不详 题型:填空题
| 电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积 | 1.8×10-11 | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | 9.7 | 5.0 | 5.5 | 4.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
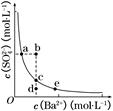
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg(OH)2的溶解度最小 | B.Ca(OH)2的溶解度最小 |
| C.AgCl的溶解度最小 | D.物质Ksp越大溶解度也越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
| C.b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D.c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 解释或结论 |
| A | 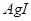 沉淀中滴入浓KCI溶液有白色沉淀出现 沉淀中滴入浓KCI溶液有白色沉淀出现 | 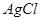 比 比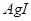 更难溶 更难溶 |
| B | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| C | 滴加氯水和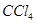 振荡,静置,下层溶液为紫色 振荡,静置,下层溶液为紫色 | 原溶液中有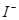 |
| D | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 含有Na单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
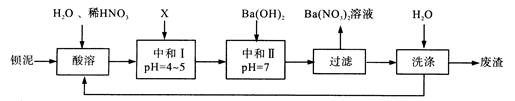
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com