
����Ŀ������ͭ���仯�������ճ��������������Ź㷺��Ӧ�á���ش��������⣺
��1������Ԫ�����ڱ��е�λ����________________��
��2�������Fe(CO)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)x��������___________��������ͣ���Fe(CO)x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x=_______��Fe(CO)x��һ�������·�����Ӧ��Fe(CO)x(s)![]() Fe(s)+xCO(g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ������Ϊ_________��
Fe(s)+xCO(g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ������Ϊ_________��
��3��д��CO��һ�ֳ����ȵ�������ӵĽṹʽ____________��������ȽϷе�ϸߵ�Ϊ__________���ѧʽ����CN����̼ԭ���ӻ��������Ϊ__________��C��N��O��Ԫ�صĵ�һ����������Ϊ_______����Ԫ�ط��ű�ʾ����
��4��ͭ��Cl�γɻ�����ľ�����ͼ��ʾ���ڵ����ͭԭ�ӣ���
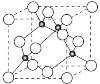
�ٸþ���Ļ�ѧʽΪ________��������Ũ���ᷢ����������ԭ��Ӧ�����������H2CuCl3����Ӧ�Ļ�ѧ����ʽΪ___________________��
����֪ͭ��M�ĵ縺�Էֱ�Ϊ1.9��3.0����ͭ��M�γɵĻ���������______������ӡ��������ۡ��������
���𰸡��������ڵڢ��� ���Ӿ��� 5 ������ N��N CO sp�ӻ� N CuCl CuCl��2HCl(Ũ)===H2CuCl3(��CuCl��2HCl(Ũ)===H2[CuCl3]) ����
��������
��1��FeΪ26��Ԫ�أ�λ�ڵ������ڵ�VIII�壻
��2��Fe��CO��x������۷е�ϵͣ��������ڷ��Ӿ��壻Feԭ�Ӽ۵�������8��ÿ��CO�����ṩһ�����Ӷԣ�����8+2n=18��n=5��ֻ����λ�����ѣ����γɵĻ�ѧ���ǽ�������
��3��ԭ�Ӹ�����ȡ��۵�������ȵ����ǵȵ����壬������CO�ǵȵ�����ķ��ӽṹʽΪN��N�����Է��ӵ��۷е�ϸߣ�CO�Ǽ��Է��ӣ������ǷǼ��Է��ӣ�����CO�۷е�ϸߣ�������Cԭ�Ӽ۲���ӶԸ�����2������Cԭ�Ӳ���sp�ӻ���ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�ͬһ����Ԫ�أ���һ����������ԭ�������������С�����Ե�һ������������NԪ�أ�
��4���������������У���������ռ![]() ����������ռ
����������ռ![]() ���ڲ�����Ϊ�����������У����һ�������У�Cu����ĿΪ4��Cl����ĿΪ8��
���ڲ�����Ϊ�����������У����һ�������У�Cu����ĿΪ4��Cl����ĿΪ8��![]() +6��
+6��![]() =4����þ���Ļ�ѧʽΪCuCl��
=4����þ���Ļ�ѧʽΪCuCl��
������Ũ���ᷢ����������ԭ��Ӧ�����������H2CuCl3����Ӧ�Ļ�ѧ����ʽΪCuCl+ 2HCl= H2CuCl3��CuCl��2HCl(Ũ)===H2[CuCl3]��
��һ����Ϊ�����ɼ�Ԫ��ԭ�Ӽ�ĵ縺�Բ�ֵ����1.7�γ����Ӽ���С��1.7�γɹ��ۼ���ͭ���ȵ縺�Բ�ֵ3.0-1.9=1.1<1.7���û��������ڹ��ۻ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��ⶨH2C2O4��xH2O ��xֵ�� ��֪��M��H2C2O4��=90 g��mol-1
����ȡ 1.260 g H2C2O4��xH2O���壬�������100.00 mL ˮ��ҺΪ����Һ��
����ȡ 25.00mL ����Һ������ƿ�У��ټ���������ϡH2SO4��
����20.00mlŨ��Ϊ 0.05000 mol��L-1�� KMnO4����Һ���еζ���
����ʾ��H2C2O4������ΪCO2 , KMnO4����ԭΪMnSO4)
��1����д����ζ��йط�Ӧ�Ļ�ѧ����ʽ______________��
��2��ijѧ���ĵζ���ʽ���гֲ�����ȥ�����£����������_____��ѡ�� a��b����
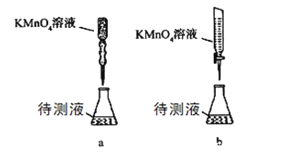
��3���ζ��������۾�Ӧע��______________________��
��4��ͨ���������ݣ����x=____________���Ա�KMnO4��Һ�ζ���Ʒ��Һ��Ũ�ȣ�δ�ñ�KMnO4��Һ��ϴ�ζ��ܣ�����ʵ����______��ƫ��ƫС��û��Ӱ�죩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ѡ�����Ը��������Һ�Ͳ���(H2C2O4)��Һ��̽����������Ի�ѧ��Ӧ���ʵ�Ӱ�죬��������������ʵ�飺[ʵ�����ݼ���¼]
��֪��2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O
ʵ�� ��� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
_mol��L-1H2C2O4��Һ | H2O | 0.05 mol��L-1KMnO4��Һ | 3 mol��L-1ϡ���� | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
��ش�
(1)[ʵ��ԭ��]_____________(д���ӷ���ʽ)��
(2)Ϊ���ʵ��Ŀ�ģ�H2C2O4��Һ�����ʵ���Ũ�Ȳ�����________��
(3)�����ϱ��е�ʵ�����ݣ����Եõ��Ľ�����_________��
(4)��С��ͬѧ���ݾ��������n(Mn2+)��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+)��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��衣����������ʵ��̽����

�ٸ�С��ͬѧ����ļ�����__________��
�����������С��ͬѧ���ʵ�鷽����
ʵ�� ��� | �����£��Թ��������Լ���������/mL | �����Թ��м�������MnSO4 | ��������Һ��ɫ������ɫ����ʱ��/min | |||
__mol��L-1 H2C2O4��Һ | H2O | 0.05 mol��L-1 KMnO4��Һ | 3 mol��L-1 ϡ���� | |||
4 | 3.0 | 1.0 | 4.0 | 2.0 | 0.1 g | t |
����С��ͬѧ����ļ��������Ӧ�۲쵽������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����³�ѹ�£�1g��̬̼��ˮ����ǡ����ȫ��Ӧ����Ӧ��������CO��H2������10.94kJ�������˷�Ӧ���Ȼ�ѧ����ʽΪ___��
(2)��֪:��CH4(g)��2O2(g)=CO2(g)��2H2O(l) ��H1=-Q1kJ��mol-1��
��2H2(g)��O2(g)=2H2O(g) ��H2=-Q2kJ��mol-1��
��2H2(g)��O2(g)=2H2O(l) ��H3=-Q3kJ��mol-1��
�����£�ȡ�����4��1�ļ���������Ļ������11.2L(��״����)������ȫȼ�պ�ָ������£���ų�������Ϊ___kJ��
(3)��H2Ϊȼ�Ͽ��Ƴ�����ȼ�ϵ�ء���֪��2H2(g)��O2(g)=2H2O(l) ��H=-572kJ��mol-1��ij����ȼ�ϵ���ͷ�228.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������н��з�Ӧ��![]() ����֪��Ӧ������ijһʱ��
����֪��Ӧ������ijһʱ��![]() ��
��![]() ��
��![]() ��Ũ�ȷֱ�Ϊ
��Ũ�ȷֱ�Ϊ![]() ��
��![]() ��
��![]() ������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ������ǣ� ��
������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ������ǣ� ��
A.![]() Ϊ
Ϊ![]() ��
��![]() Ϊ
Ϊ![]() B.
B.![]() Ϊ
Ϊ![]()
C.![]() Ϊ
Ϊ![]() ��
��![]() Ϊ
Ϊ![]() D.
D.![]() ��
��![]() ��Ϊ
��Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����顢���顢��ȩ�Ļ��������ͬ��ͬѹ�º�CO2���ܶ���ͬ�����������������ȿ�����( )
��2��1��4 ��5��2��1 ��2��5��1 ��6��3��2 ��4��2��3
A. �٢�B. �ڢ�C. �ۢܢ�D. �٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������״���;����㷺����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ����2L�ܱո��Ե������ڣ��������ʵ���֮��Ϊ![]() ��
��![]() ��
��![]() ��400��ʱ��Ӧ��
��400��ʱ��Ӧ��![]()
��ϵ��![]() ��ʱ��ı仯���±���
��ʱ��ı仯���±���
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)��![]() ��ʾ��0~2s�ڸ÷�Ӧ��ƽ������
��ʾ��0~2s�ڸ÷�Ӧ��ƽ������![]() _______________��
_______________��
(2)��˵���÷�Ӧ�Ѵﵽƽ��״̬����_______________��
a��![]() b��������ѹǿ���ֲ���
b��������ѹǿ���ֲ���
c��![]() d���������ܶȱ��ֲ���
d���������ܶȱ��ֲ���
(3)�ﵽƽ��ʱ���״���ƽ����ϵ�е��������Ϊ__________������С�����һλ����
(4)![]() ��
��![]() �ķ�Ӧ�ɽ���ѧ��ת��Ϊ���ܣ������������������Һ�γ�ԭ��أ�
�ķ�Ӧ�ɽ���ѧ��ת��Ϊ���ܣ������������������Һ�γ�ԭ��أ�![]() Ӧͨ���ص�_________�����������������������������ĵ缫��ӦʽΪ_____________��
Ӧͨ���ص�_________�����������������������������ĵ缫��ӦʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����м׳ص��ܷ�ӦʽΪ2CH3OH��3O2��4KOH===2K2CO3��6H2O������˵����ȷ���ǣ� ��
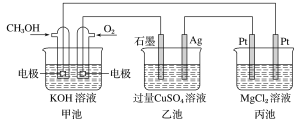
A. 1min�ڼ׳�����1mol O2ת�Ƶĵ������ҳ�Ag�缫ת�Ƶ�������4��
B. �׳�ͨ��CH3OH�ĵ缫��ӦʽΪCH3OH��6e����2H2O===CO32-��8H��
C. ��Ӧһ��ʱ������ҳ��м���һ����Cu(OH)2������ʹCuSO4��Һ�ָ���ԭŨ��
D. �׳�������280mL(��״����)O2����ʱ������������������1.45g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�־��и������ȵ����ɵ��ʾ��ͼ��ͼ��ʾ��ʯī�缫�������ĵ缫��ӦΪMnO2+e��+H2O=MnO(OH)+OH-����װ�ù���ʱ������������ȷ����
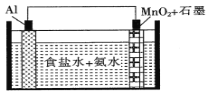
A. ʯī�缫�ϵĵ��Ʊ�Al�缫�ϵĵ�
B. Al�缫���ĵ缫��Ӧʽ��A1-3e-+3NH3��H2O=Al(OH)3+3NH4+
C. ÿ����27gAl����3mol����ͨ����Һת�Ƶ�ʯī�缫��
D. ������ʳ��ˮ+NaOH��Һ���������Һ���缫��Ӧʽ��ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com