
| A. | ①② | B. | ②③④ | C. | ①②④ | D. | ③④ |
分析 ①依据向氯化铝溶液中滴加氢氧化钠溶液,先生成沉淀后变澄清;
②依据偏铝酸钠的性质,加入酸生成氢氧化铝沉淀,继续加入沉淀溶解;
③依据氢氧化铝能溶解在过量的氢氧化钠中,继续滴入最终会产生白色沉淀分析;
④依据氢氧化铝不溶于弱碱分析;
解答 解:在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是:
①向氯化铝溶液中滴加氢氧化钠溶液,发生的反应为;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+H2O,故①符合;
②向偏氯酸钠溶液中加盐酸发生的反应为:AlO2-+H++H2O=Al(OH03↓;Al(OH03+3H+=Al3++3H2O,故②符合;
③向氢氧化钠溶液中滴加氯化铝溶液,由于在滴加过程中碱是过量,所以生成的氢氧化铝沉淀会溶解在过量的氢氧化钠溶液中,继续滴加最终生成白色沉淀,故③不符合;
④向氯化铝溶液中滴加氨水,由于生成的氢氧化铝不溶于氨水弱碱,所以滴加氨水会生成白色沉淀,故④不符合;
综上所述①②
故选A.
点评 本题考查了物质性质的应用,胶体的聚沉性质,关键是试剂在滴加顺序不同时现象不同,产物不同的判断.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
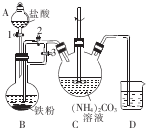 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{55}^{131}$I的化学性质与${\;}_{53}^{127}$I是相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生白色沉淀 | |
| B. | 已知CuS和FeS都难溶于水,将H2S分别通入CuCl2和FeCl2溶液,都会产生沉淀 | |
| C. | 向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀;再加入NaHSO4溶液,沉淀可消失 | |
| D. | 形状基本一样的纯净锌块和含铜、铁等杂质的锌块分别与相同浓度的稀硫酸反应纯净的锌块反应产生氢气的速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com