
| A、用二氧化碳和环氧丙烷生产可降解高聚物有利于环境和生态 |
| B、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| C、光导纤维的主要成分不是二氧化硅而是单晶硅 |
| D、人体摄入油脂,在体内水解可得到高级脂肪酸和甘油 |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:

 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有查看答案和解析>>
科目:高中化学 来源: 题型:
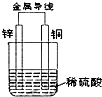 如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )| A、能将电能转换为化学能 |
| B、溶液会逐渐变为蓝色 |
| C、锌片是负极,发生氧化反应 |
| D、外电路中电子由铜片经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是( )| A、电池总反应为:4NH3+3O2=2N2+6H2O |
| B、电池工作时,OH-向正极移动 |
| C、电极2发生的电极反应为:O2+4H++4e-=2H2O |
| D、电流由电极1经外电路流向电极2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)=(2)=(3) |
| B、(1)=(2)>(3) |
| C、(1)>(2)>(3) |
| D、(2)>(1)=(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
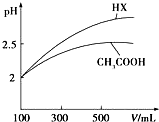 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
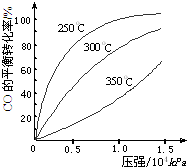 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电 |
| B、铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大 |
| C、燃料电池具有能量利用率高、可连续使用和污染轻等优点 |
| D、锂电池是一种高能电池,体积小、重量轻,单位质量能量比高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com