
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是
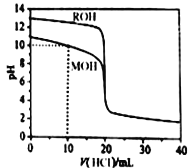
A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
【答案】A
【解析】根据图知,未加HCl溶液时,ROH的pH=13,说明c(OH-)= c(ROH),为强碱;MOH的pH小于13,则MOH为弱碱;A.MOH溶液中加入10mLHCl 溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小;B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐, M+水解导致溶液呈酸性,但水解程度较小;C.10mL<V(HCl)<20mL时,溶液中溶质为MOH和MCl,且c(MCl)>c(MOH),溶液中存在物料守恒;D.V(HCl)>20mL时,HCl过量导致溶液呈酸性,根据电荷守恒得c(Cl-)>c(M+),溶液中溶质存在有c(MCl)=c(HCl)、c(MCl)>c(HCl)、c(MCl)<c(HCl)三种情况。
根据图知,未加HCl溶液时,ROH的pH=13,说明c(OH-)=c(ROH),为强碱;MOH的pH小于13,则MOH为弱碱;A.MOH溶液中加入10mL 盐酸溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小,氯离子不水解,所以c(Cl-)>c(MOH),A正确;将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐, M+水解导致溶液呈酸性,但水解程度较小,R+不水解,所以存在c(R+)>c(M+)>c(H+)>c(OH-),B正确;10mL<V(HCl)<20mL时,溶液中溶质为MOH和MCl,且c(MCl)>c(MOH),溶液中存在物料守恒c(M+)+c(MOH)<c(Cl-),C错误;V(HCl)>20mL时,HCl过量导致溶液呈酸性,根据电荷守恒得c(Cl-)>c(M+),溶液中溶质存在有c(MCl)=c(HCl)、c(MCl)>c(HCl)、c(MCl)<c(HCl)三种情况,可能出现c(Cl-)>c(M+)=c(H+)>c(OH-),D错误;正确选项A。


科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,互为同系物的是____(填字母,下同),互为同分异构体的是____。
A.CH3CH2CH2CHO与![]() B.
B.![]() 与
与![]()
C.![]() 与
与![]() D.
D.![]() 与
与
E.![]() 与
与![]() F.戊烯和环戊烷
F.戊烯和环戊烷
(2)![]() 的分子式为____,按碳的骨架分,该有机物属于____(填字母)。
的分子式为____,按碳的骨架分,该有机物属于____(填字母)。
a.环状化合物 b.脂环烃
c.芳香族化合物 d.苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(各步反应恰好完全进行):

(1)沉淀的化学式:沉淀1________,沉淀2________,沉淀3________。
(2)写出下列反应的离子方程式:
①混合液+A:___________________________________________________________________。
②溶液+B:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下两幅图,可判断出下列离子方程式中错误的是( )

A. 2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B. Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C. 2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D. 2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
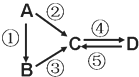
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是
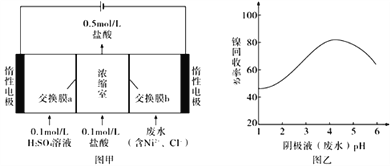
A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,甲中盛有100mL 0.1mol/LCuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
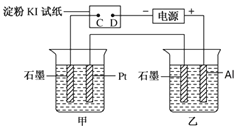
(1)通电一段时间,观察到湿润的淀粉KI试纸的_____(选填“C” 或“D”)端变蓝。
(2)装置乙中Al极的电极反应式为:_____________________。一段时间后观察到装置乙中的现象是:_________________。
(3)若电解一段时间后,装置甲中收集到气体0.056 L(标准状况下),则:装置甲中发生反应的离子反应方程式为______________________________。
(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,则电解过程中转移电子的物质的量为__________。
(5)某新型燃料电池,以甲醇为燃料,另一极通入一定量的CO2和O2的混合气体。一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,则负极反应式为______________。正极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com