
【题目】下图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与实验事实不相符的是
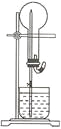
A.CO2(NaHCO3溶液) 无色喷泉B.NH3(H2O含酚酞) 红色喷泉
C.CO2(NaOH溶液) 无色喷泉D.HCl(AgNO3溶液) 白色喷泉
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见如图。有关说法错误的是( )

A.晶体中碳原子键全部是碳碳单键
B.石墨烯与金刚石都是碳的同素异形体
C.石墨烯中所有碳原子可以处于同一个平面
D.从石墨中剥离得到石墨烯需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式_______.
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则______.
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N21mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组实验中以NH3表示反应的速率是_____,与前三组相比,NH3生成量最小的原因可能是______.
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是_____.请用电离平衡理论解释上述实验现象________________________.
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是______.
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气标准状况,实验记录如表累计值:
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积 | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5min)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是__。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是__。
②该反应达到平衡状态的标志是__。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成2mol Z的同时生成3mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在常温下发生水解时,对应的离子方程式正确的是
①NaHCO3:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
②NH4Cl:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
③CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
④NaF:F-+H2O===HF+OH-
A. ①②B. ②③C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物存在着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(g)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=___;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___;
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态。
①___;②___。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___。
a.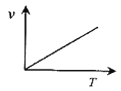 b.
b.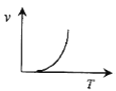
c.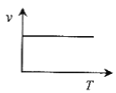 d.
d.
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___;欲使上述体系中Al3+浓度增加,可加入的物质是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中 P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S中S原子sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________ g。
(2)钠—钾合金可在核反应堆中用作热交换液。5.05 g钠—钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。________
②计算并确定该钠-钾合金的化学式。______________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2―→2Al(OH)3↓+Na2CO3+H2O,己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
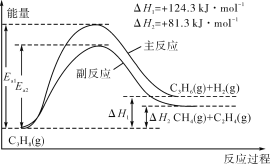
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com