
| A.Ca2+、Na+、NO3-、SO42- | B.HCO3-、Na+、Cl-、H+ |
| C.Mg2+、Cl-、Cu2+、SO42- | D.K+、Ba2+、Cl-、NO3- |
科目:高中化学 来源:不详 题型:单选题
| A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 |
| B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ |
| C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
| D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Fe2+、CH3COO-、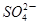 、Na+ 、Na+ |
B.Ca2+、K+、Cl-、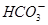 |
C.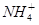 、Al3+、 、Al3+、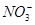 、Cl- 、Cl- |
D.K+、Na+、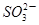 、 、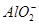 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃由水电离的c(H+)= 10-12mol/L 的溶液:Fe3+ Cl-NO3- K+ |
| B.使酚酞变红的溶液:Na+ Cl- SO42-AlO2- |
| C.某无色溶液:HCO3-NO3- Al3+ Ba2+ |
| D.25℃时,pH=1的溶液: Ba2+ NO3- K+ I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO32-、OH-、Na+、H+ | B.Al3+、Na+、AlO2-、Cl- |
| C.Ba2+、HCO3-、K+、SO42- | D.S2-、H+、SO42-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH?) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH?) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
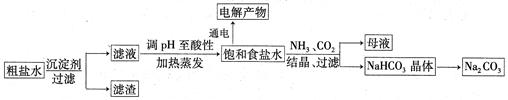
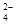 ,得到纯净的NaCl晶体,需加入以下试剂:
,得到纯净的NaCl晶体,需加入以下试剂:| A.过量的NaOH溶液; | B.过量的Na2CO3溶液; | C.适量的盐酸; | D.过量的BaCl2溶液。 |
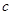 (OH-)的比值是_________。
(OH-)的比值是_________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
| A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能共存,Al3++3OH-=Al(OH)3↓ |
| B | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能共存, 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
| C | 由水电离出的H+浓度为1×10-12mol/L | NH4+、Na+、NO3-、Cl- | 一定共存,NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能共存, 2ClO-+SO2+H2O=2HClO+SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com