
常见的污染物分为一次污染物和二次污染物。二次污染物是指排入环境中的一次污染物在物理化学因素或微生物作用下发生变化所生成的新污染物。如反应2NO+O2═2NO2中,二氧化氮为二次污染物,下列物质中不会导致二次污染的是( )
①SO2 ②NO ③NO2 ④HCl ⑤CO2
A.①②③④⑤ B.①③⑤ C.④⑤ D.④
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:2015-2016学年河北沧州一中高一上第二次月考化学试卷(解析版) 题型:填空题
我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)该反应的离子方程式为 。
(2)用“双线桥”表示出反应中电子转移的方向和数目:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(3)氧化产物与还原产物的质量之比为 。
(4)如果反应中转移0.2mol电子,则生成I2的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州贵阳花溪清华中学高一6月月考化学卷(解析版) 题型:选择题
下列反应既属于氧化还原反应,又属于吸热反应的是
A.铝片与稀盐酸反应 B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应 D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头一中高一下学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.原子核外各电子层容纳的电子数为2n2个
C.核外电子的分层排布就是核外电子的分层运动
D.ⅥA族元素的原子,其半径越大,越容易得电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头一中高一下学期期中考试化学试卷(解析版) 题型:选择题
下列表达式中正确的是( )
A.氯化氢分子的电子式: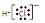
B.S2-的结构示意图: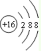
C.四氯化碳的电子式:
D.N2分子的结构式:N=N
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头一中高二下学期期中考试化学试卷(解析版) 题型:实验题
(普通)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
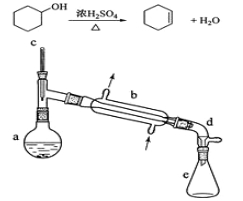
可能用到的有关数据如下:
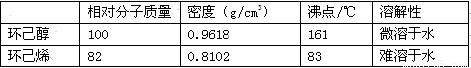
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置a的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 (填正确答案标号)。
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头一中高二下学期期中考试化学试卷(解析版) 题型:选择题
下列各组中两个化学反应,属于同一反应类型的一组是:
A.由苯制硝基苯;由苯制环己烷
B.由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷
C.乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
D.由苯制溴苯;CH4制CH2Cl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二第三次月考化学试卷(解析版) 题型:选择题
某有机物分子式为C3H6O2在酸性条件下水解得一元酸A与一元醇B,A与B的相对分子质量相等,则以下结论不正确的是
A.A中含碳26.09%
B.A具有还原性
C.B经氧化也可得到一元酸且酸性比A强
D.B分子结构中有甲基
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高二下期中化学试卷(解析版) 题型:填空题
I .(1)同温同压下,物质的量为2:3的SO2气体和SO3气体,其原子个数之比为 ,气体密度之比为 。相同质量的SO2气体和SO3气体,其分子数之比为
(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 .
II.Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术.
(1)实验室制取Fe(OH)3 相应的离子方程式是 .
(2)氢氧化铁胶体还可以和次氯酸钠在碱性介质中反应得到铁酸钠Na2FeO4,铁酸钠具有强氧化性从而对来自河湖的淡水的进行消毒,请给下列方程式配平
Fe3++ ClO﹣+ OH-﹣= FeO42-﹣+ Cl-﹣+ H2O.
III(1)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.写出TiCl4在潮湿空气中水解的化学方程式是_________________
(2) 已知TiO2+2Cl2+2C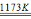 TiCl4+2CO ,TiCl2、Cl2和C反应制得的TiCl4最好的提纯方法是__________(填操作名称)。
TiCl4+2CO ,TiCl2、Cl2和C反应制得的TiCl4最好的提纯方法是__________(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com