
| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| D. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl) |
分析 A.根据用浓氨水检验Cl2管道是否泄漏的反应式为3Cl2+8NH3=N2+6NH4Cl来分析;
B.氢氟酸为弱酸;
C.常温下,浓硫酸和铝发生钝化现象,在铝的表面形成致密的氧化膜;
D.钠的金属性比钾弱.
解答 解:A.在反应3Cl2+8NH3=N2+6NH4Cl中,氨气做还原剂,表现还原性,故A错误;
B.氢氟酸为弱酸,不具有强酸性,氢氟酸能与玻璃中二氧化硅反应,所以用氢氟酸蚀刻玻璃,故B错误;
C.常温下,浓硫酸和铝发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,常温下用铝制容器贮藏贮运浓硫酸,故C正确;
D.钠的金属性比钾弱,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl),是因为K的沸点比Na的低,分离出钾蒸汽,反应不断向正方向进行,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉氨气、氢氟酸、铝、Na、K的性质是解题关键,注意铝与冷的浓硝酸的钝化反应,题目难度不大,侧重于考查学生的分析、应用能力.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属熔点的高低 | B. | 金属阳离子得电子的能力 | ||
| C. | 金属在自然界的存在形式 | D. | 金属元素在地壳中的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA | |
| B. | 标准状况下,2.24 L Cl2与氢氧化钠溶液完全反应转移电子数为0.1NA | |
| C. | 1 mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7,Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
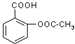 试根据阿斯匹林的结构回答;
试根据阿斯匹林的结构回答; ,其分子式为C7H6O3,则B的结构简式为CH3COOH;
,其分子式为C7H6O3,则B的结构简式为CH3COOH;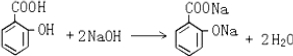 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com